|
Distillation : diagramme isobare binaire liquide vapeur ; Concours Capes externe 2008 |
|||||||
|
|||||||
|
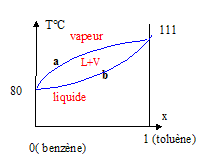
Qu'appelle t-on mélange idéal ? Microscopiquement la solution se comporte comme un liquide pur : les interactions entre molécules différentes et molécules identiques sont égales. Il faut pour cela que les molécules soient assez semblables. Calculer la variance du système contenant un mélange de ces 2 produits présents à la fois en phase vapeur et en phase liquide. La règle des phases donne la variance d'un système thermodynamique. v = c+1-j c : nombre de constituants indépendants ( nombre de constituants - nombre de réactions chimiques indépendantes entre ces constituants) c = 2 ; la pression n'est pas un facteur pouvant modifier l'équilibre.( isobare) j : nombre de phases présentes ( liquide homogène et vapeur ). j = 2 v= 2+1-2 = 1; on peut faire varier la température. Pourquoi doit-on préciser que l'on conduit une étude isobare de l'équilibre liquide - vapeur ? Les températures d'ébullition dépendent de la pression. Données : Benzène : T ébullition =80°C ; toluène Tébullition = 111 °C. Tracer l'allure du diagramme binaire liquide vapeur isobare pour ce mélange. Localiser la courbe de rosée, la courbe d'ébullition. courbe a : courbe de rosée, ensemble des points où apparaît la première goutte de liquide lorsqu'on refroidit de la vapeur. courbe b : courbe de d'ébullition, ensemble des points où apparaît la première goutte de vapeur lorsqu'on chauffe le liquide.
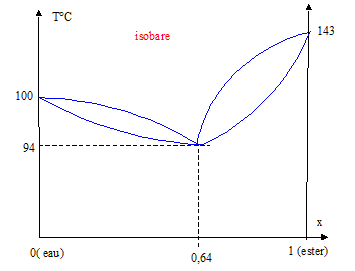
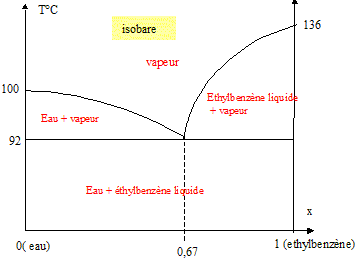
Hydrodistillation, entraînement à la vapeur. On s'intéresse ici aux cas de mélanges binaires avec une solubilité nulle à l'état liquide, l'un des deux composants étant l'eau. L'éthylbenzène et l'eau ne sont pas miscibles en phase liquide et donne un diagramme binaire avec hétéroazéotrope. Le mélange hétéroazéotropique a une fraction massique en éthylbenzène de 67 % et sa température d'ébullition est 92°C sous 1 bar. Données : éthylbenzène : T ébullition =136°C. Tracer l'allure du diagramme binaire liquide vapeur isobare pour ce mélange. Indiquer dans chaque domaine quelles sont les phases en présence.
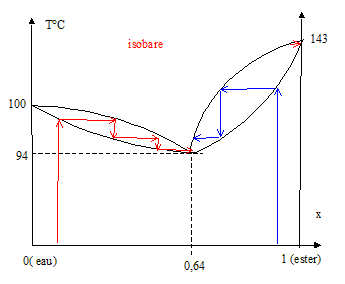
Décrire l'évolution isobare d'un système fermé, contenant au départ une fraction massique de 50 % d'éthylbenzène, auquel on apporte de façon régulière de la chaleur. Préciser l'apparition de nouvelles phases, la façon dont varie la température ( entre 80 et 110°C) en justifiant. L'ébullition commence à 92°C ; la vapeur a la composition suivante : ( 67 % d'éthylbenzène). Dans le ballon le liquide s'enrichit donc en eau ; la température reste égale à 92 °C tant qu'il y a de l'éthylbenzène dans le ballon. Puis l'ébullition cesse et la température
de l'eau du ballon s'élève ; à
100°C l'eau commence à bouillir et la
température reste constante tant que le ballon
contient de l'eau.
Préciser l'apparition de nouvelles phases, la façon dont varie la température ( entre 80 et 110°C) en justifiant. L'ébullition commence à 92°C ; la vapeur a la composition suivante : ( 67 % d'éthylbenzène). Dans le ballon le liquide s'enrichit donc en éthylbenzène ; la température reste égale à 92 °C tant qu'il y a de l'eau dans le ballon. Puis l'ébullition cesse et la température de l'éthylbenzène du ballon s'élève ; à 136°C l'éthylbenzène commence à bouillir et la température reste constante tant que le ballon contient de l'éthylbenzène.
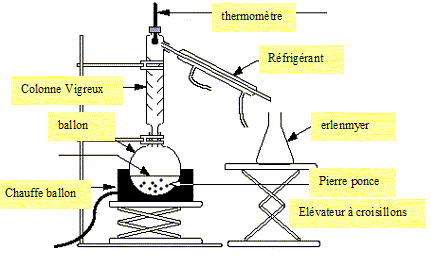
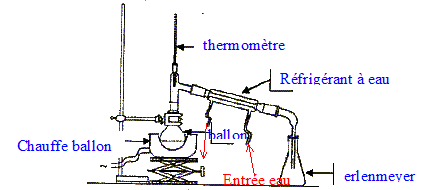
Dessiner le schéma du montage d'une hydrodistillation, nommer les différents matériels utilisés dans ce montage.
Pour extraire tout l'éthylbenzène doit-on partir d'une fraction massique en eau supérieure ou inférieure à 33% ? Justifier. Evolution isobare d'un système fermé, contenant au départ une fraction massique de 50 % d'éthylbenzène, auquel on apporte de façon régulière de la chaleur. L'ébullition commence à 92°C ; la vapeur a la composition suivante : ( 67 % d'éthylbenzène). Dans le ballon le liquide s'enrichit donc en eau ; la température reste égale à 92 °C tant qu'il y a de l'éthylbenzène dans le ballon. Puis l'ébullition cesse et la température de l'eau du ballon s'élève. Quelle est la différence entre une hydrodistillation et un entraînement à la vapeur ? Dans quel cas doit-on privilégier cette méthode ? Hydrodistillation : On distille le mélange hétérogène eau + produit naturel ; on récupère un mélange eau + composé organique qui bien souvent surnage. Entraînement à la vapeur : On injecte de la vapeur d'eau dans un liquide organique ; celui-ci est chauffé par la vapeur d'eau et distille avec elle : il est entraîné. Le corps à entraîner doit avoir une tension de vapeur non négligeable à la température d'entraînement. Cette méthode est intéressante si la température d'ébullition du corps organique est élevée.
|
|||||||
|
|
|||||||
|
|