|
Extraction liquide liquide : unique ou en plusieurs étapes ; influence du pH Concours Capes externe 2008 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
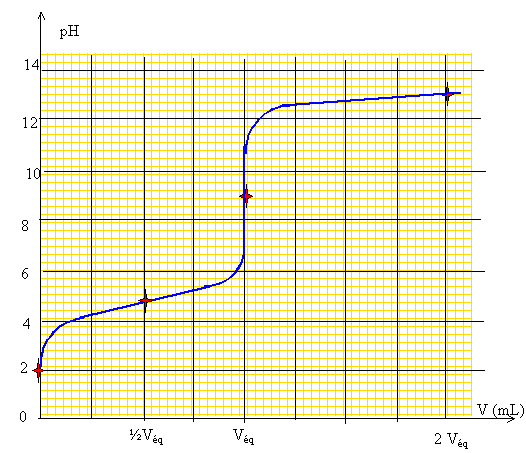
Extraction liquide liquide. On envisage une solution aqueuse d'acide propanoïque. A quels critères doit répondre le solvant d'extraction utilisé afin d'extraire le plus totalement possible l'acide propanoïque ? Le solvant ne doit pas être miscile à l'eau. La substance à extraire doit être très soluble dans ce solvant, et peu soluble dans l'eau. On a réalisé dans une fiole jaugée de 150 mL une solution d'acide propanoïque contenant environ 11,1 g d'acide. On va dans un premier temps doser 5,0 mL de cette solution auxquels on a ajouté 100 mL d'eau à l'aide de soude à 0,20 mol/L. Ecrire l'équation de la réaction de dosage. Vérifier qu'elle est quantitative. Calculer l'ordre de grandeur du volume équivalent attendu. Couple acide base :CH3-CH2-COOH / CH3-CH2-COO- : pKa = 4,9 ; H2O / HO- : pKe= 14 CH3-CH2-COOH + HO- = CH3-CH2-COO- + H2O. K = [CH3-CH2-COO-] /([CH3-CH2-COOH][HO-]) Or Ka =[CH3-CH2-COO-][H3O+] / [CH3-CH2-COOH] ; [CH3-CH2-COO-] /[CH3-CH2-COOH] =Ka/[H3O+] repport dans K : K =Ka/( [H3O+][HO-]) =Ka/Ke= 10-4,9 / 10-14 = 109,1. K est grand : la réaction est quantitative. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. CaVa = CbVéq d'où Véq =CaVa / Cb= 1*5/0,2 ; Véq = 25 mL. M(acide propanoïque) = 74 g/mol ; n=11,1 / 74 = 0,15 mol dans 0,15 L soit Ca = 1,0 mol/L Tracer l'allure de la courbe de dosage pH-métrique attendue en précisant la valeur de pH attendue pour V=0 mL, ½VE, VE, 2VE, V représentant le volume de soude versée et VE le volume équivalent. Les hypothèses devront être clairement explicitées. CH3-CH2-COOH
+H2O
=CH3-CH2-COO-+H3O+
. Ka = 10-4,9. La réaction de
l'acide propanoïque avec l'eau est très
limitée. [CH3-CH2-COOH]
+
[CH3-CH2-COO-]
=Ca. [CH3-CH2-COOH]
voisin Ca. La solution est électriquement neutre :
[CH3-CH2-COO-]
=[H3O+] Ka
=[CH3-CH2-COO-][H3O+]
/
[CH3-CH2-COOH]
=[H3O+]2/Ca. [H3O+]
= (Ka
Ca)½. pH
=½(pKa
-logCa) =0,5(4,9-log 1) =
2,45.
Dans une ampoule à décanter, on introduit un volume V0 = 35,0 mL de la solution contenue dans la fiole jaugée, puis on y ajoute un volume vs = 75,0 mL d'éther et on agite énergétiquement l'ampoule pendant 5 min en pensant à dégazer de temps en temps. Pourquoi doit-on dégazer ? Suppression de la surpression résultant de l'agitation vigoureuse. Définir la constante de partage ( ou coefficient de partage) K de l'acide propanoïque entre les deux phases ( on confondra concentration et activité). De quoi dépend cette constante ? Le coefficient de partage k ne dépend que de la température et de la nature des solvants ; k est le rapport des concentrations molaires d'une espèce notée E dans deux phases aqueuse et organique non miscibles : k = [E]org / [E]aq . Après décantation on dose 10,0 mL de la phase aqueuse par la soude à 0,20 mol/L. En utilisant l'indicateur judicieusement choisi on trouve un volume équivalent de 7,6 mL. Calculer la masse m1 d'acide restant en phase aqueuse ainsi que la masse d'acide présente dans la phase organique après extraction. 7,6*0,2 =1,52 mmol dans 10 mL ; 1,52*35/10 =5,32 mmol d'acide propanoïque dans 35 mL. m1 = 5,32 10-3*74 ; m1 = 0,394 g. masse d'acide dans la phase organique : m0-m1 =2,59-0,394 ; m0-m1 = 2,20 g. En déduire la valeur du coefficient de partage de l'acide propanoïque entre les deux phases. n(E)eau = m1 /M ; [E]aq = m1 /(MVeau ) ; n(E)org = (m0-m1) /M ; [E]org = (m0-m1) /(MVorg ) k = [E]org / [E]aq = (m0-m1) Veau / (m1Vorg ) =2,2*35/(0,394*75) ; k=2,6.
On dose 10,0 mL de la phase aqueuse par la soude à 0,20 mol/L. En utilisant l'indicateur judicieusement choisi on trouve un volume équivalent de 2,3 mL. Calculer la masse m3 d'acide restant en phase aqueuse ainsi que la masse d'acide présente dans les 75 mL d'éther. Commenter. 2,3*0,2 =0,46 mmol dans 10 mL ; 0,46*35/10 =1,61 mmol d'acide propanoïque dans 35 mL. m3 = 1,61 10-3*74 ; m3 = 0,119 g. Cette méthode est beaucoup plus efficace que la précédente. Il vaut mieux effectuer n extractions avec le volume Vorg/n de solvant, plutôt qu'une seule avec le volume Vorg de solvant.
Exprimer la masse m d'acide contenu dans un volume V0 d'eau en fonction de m0, V0, Vs, K après une extraction unique avec un volume Vs d'éther. m0 = m + mether ; k = [E]ether / [E]aq = mether V0 / (mVS ) ; mether=k m VS /V0 m0 = m + mether = m+k m VS /V0 = m(1+k VS /V0 ) m = m0 / (1+k VS /V0 ). Exprimer la masse mn d'acide contenu dans un volume V0 d'eau en fonction de m0, V0, Vs, K après n extractions avec un volume Vs / n d'éther. Comparer mn et m. n=2 : m2 = m / (1+k VS /(2V0) ) = m0/ (1+k VS /(2V0) )2. n=3 : m3 = m2 / (1+k VS /(3V0) ) = m0/ (1+k VS /(3V0) )3. n=n : mn = mn-1 / (1+k VS /(nV0) ) = m0/ (1+k VS /(nV0) )n. Calculer m3 avec les valeurs précédentes de m0, V0, Vs, K. Comparer à la valeur expérimentale. m3 =m0/ (1+k VS /(3V0) )3 =2,59 /(1+2,6*75/3*35))3=0,11.
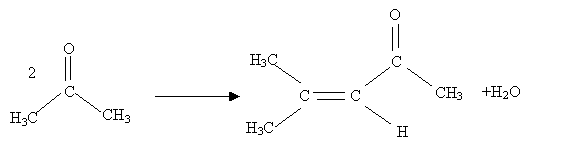
Que se passe t-il si on chauffe légerement en milieu basique ( par exemple en présence de baryte Ba(OH)2) de la propanone ? Formation d'un alcool cétonique qui par chauffage donne une a-ènone.
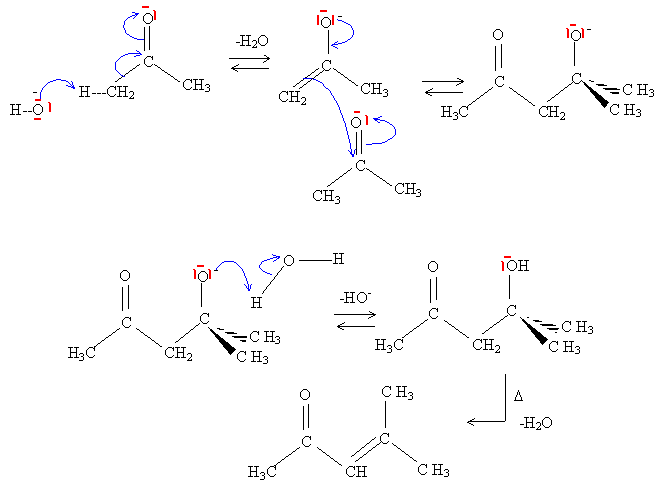
Ecrire l'équation de la réaction puis donner le mécanisme de cette réaction.
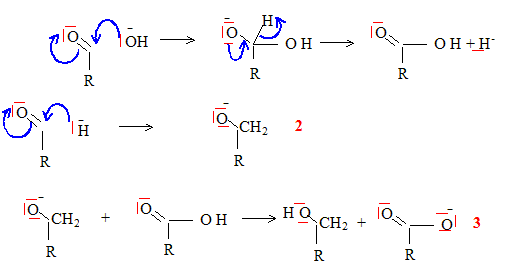
La réaction précédente étant un équilibre de constante faible, proposer un montage classiquement utiliser pour déplacer cet équilibre. Commenter ce montage et expliquer comment il permet d'améliorer le rendement. Propanone : Tébullition = 56°C. Extrateur de Soxhlet : extraction du produit au fur et à mesure de sa formation ; l'équilibre est ainsi déplacé dans le sens direct, formation de l'énol. En phase aqueuse en présence d'un hydroxyde alcalin très concentré, le benzaldehyde ( phénylméthanal) ne donne pas le même type de réaction ; proposer une explication. On place un aldehyde non énolisable ( pas d'hydrogène en a du C=O) du type R-CHO, en présence d'ions hydroxyde HO-. La seule action possible de l'ion hydroxyde est une attaque nucléophile sur le carbone du groupe fonctionnel du méhanal, suivie de la formation d'un ion hydrure.
(2) réduction de l'aldehyde en ion alcoolate par l'ion hydrure ; (3) réaction acide base. Si R est le noyau benzénique, l'ion énolate est stabilisé par résonance. bilan : dismutation de l'aldehyde non énolisable. 2R-CHO + HO- --> RCH2OH + RCOO-. Il se dismute, écrire l'équation chimique traduisant cette réaction. Après avoir
réalisé la réaction
précédente, on ajoute éventuellement de
l'eau afin de faire disparaître toute trace de solide
puis on transvase dans une ampoule à décanter,
on lave alors à deux reprises la solution aqueuse
avec du toluène. Commenter ces dernières étapes en pensant à préciser quelles sont les espèces présentes dans la phase aqueuse. L'alcool benzylique est dans la phase organique( toluène) ; l'ion benzoate se trouve dans la phase aqueuse.
Expliquer ce qui s'est passer lors de l'ajout d'acide chlorhydrique et justifier la non solubilité dans l'eau du produit finalement obtenu. Couple acide base F-COOH / F-COO-. A pH=1, la forme acide F-COOH prédomine ; or ce dernier est très peu soluble dans l'eau. ( l'acide benzoïque possède un noyau benzénique ne présentant aucune affinité pour un solvant polaire comme l'eau ). L'acide benzoïque précipite ( solide blanc). |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|