|
Distillation, diagramme binaire agrégation 2008. |
|||||||||||||||||
|
|||||||||||||||||
|
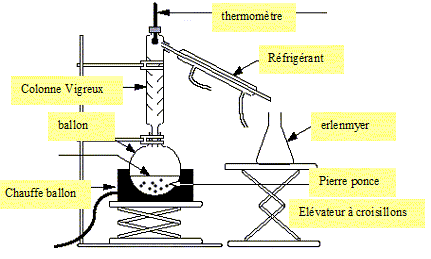
Distillation au lycée. Comment montrer expérimentalement la différence entre distillation simple et distillation fractionnée. La distillation simple ne comporte pas de colonne Vigreux, on l'utilise pour distiller des solvants volatils ou des composés possédant des températures d’ébullition très différentes. La distillation fractionnée permet de recueillir un distillat de plus grande pureté. On peut donc différencier ces deux types de distillation en suivant la qualité du distillat. Dresser la liste du matériel nécessaire pour réaliser une distillation fractionnée.
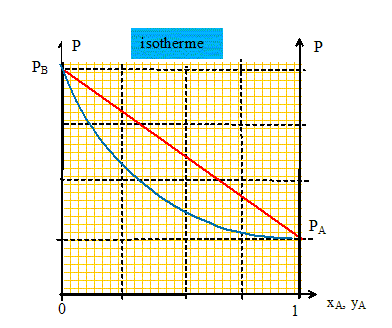
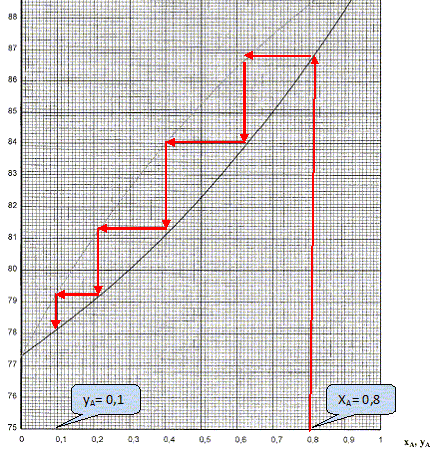
Quel est le composé le plus volatil ? En déduire une comparaison des pressions de vapeur saturante de A et B à une température donnée. La température d'ébullition de B est inférieure à celle de A : B est plus volatil que A. PA* < PB* à une température donnée. On considère que le mélange est idéal : rappeler les lois qui permettent de tracer les courbes P= f(xA) et P= f'(yA) dans un diagramme isotherme. Loi de Raoult : la pression de vapeur de A dans un mélange est proportionnelle à sa fraction molaire xA dans le mélange. PA = xA PA * ; PB = xB PB *. Loi de Dalton : la pression totale est égale à la somme des pressions partielles des constituants du mélange. La pression partielle d'un gaz dans un mélange est égale au produit de la pression totale du mélange par la fraction molaire du gaz considéré PA = yA P ; PB = yB P. Donner les équations de ces courbes et tracer l'allure de ce diagramme isotherme. P =PA + PB = xA PA* + xB PB*= xA PA* +(1- xA ) PB*= PB* + xA ( PA* - PB*). P =PB* + xA ( PA* - PB*) , équation d'une droite de pente négative( PA*< PB*).
P[ PA* - yA ( PA* - PB*) ] =PA*PB*
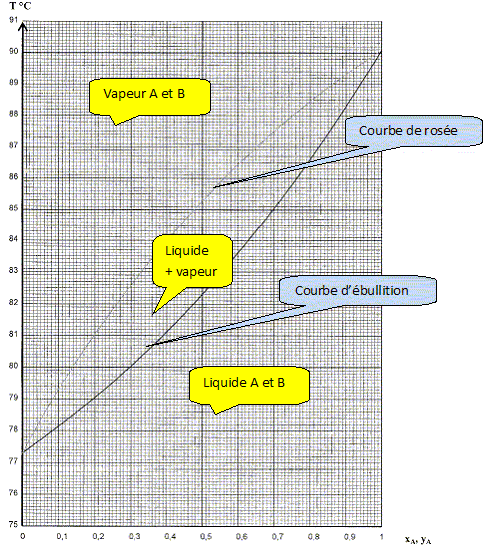
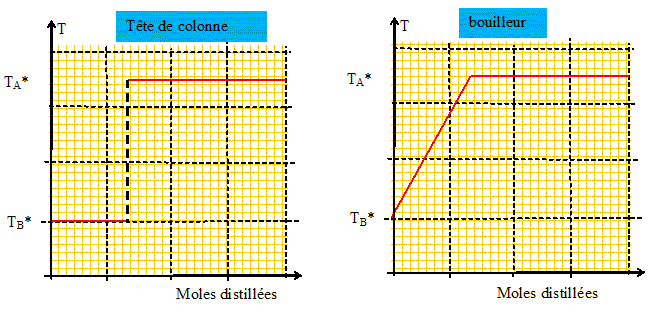
Que récupère t-on dans le distillat ? Le liquide le plus volatil B. Comment évolue la température en tête de colonne ? Pour cela on tracera l'allure de la courbe T= f(nombre de moles distillées) en supposant que l'on distille le mélange jusqu'au bout. Parallèlement comment évolue la température dans le bouilleur ?
Sachant que, à partir d'un mélange initial xA=0,8, on récupère un distillat de composition yA=10, déterminer à partir du diagramme le nombre de plateaux théoriques de la colonne.
4 plateaux théoriques.
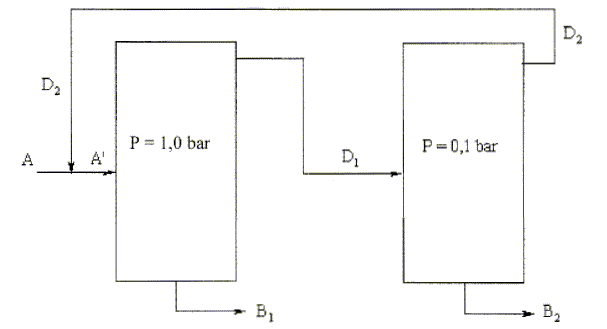
Mélange méthanol-butanone. On s'intéresse au mélange binaire de méthanol ( composé 1) et de butanone ( composé 2). L'installation de distillation est schématisée de façon simplifiée ci-dessous et comprend deux colonnes fonctionnant à deux pressions différentes. Les pressions totales sont considérées comme constantes et égales à 1,0 bar dans la première colonne et 0,1 bar dans la seconde colonne. On donne les diagrammes binaires isobares.
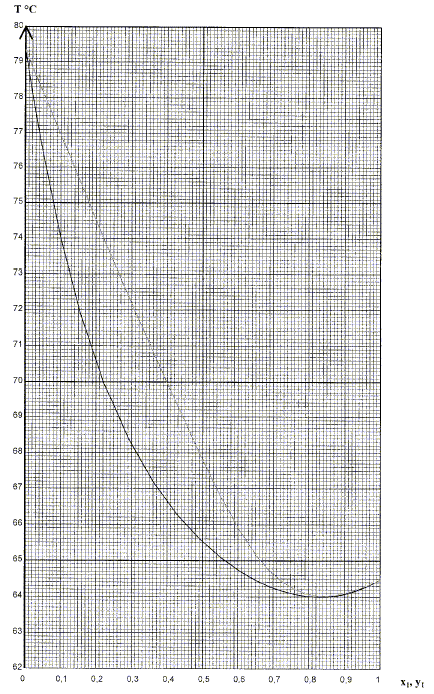
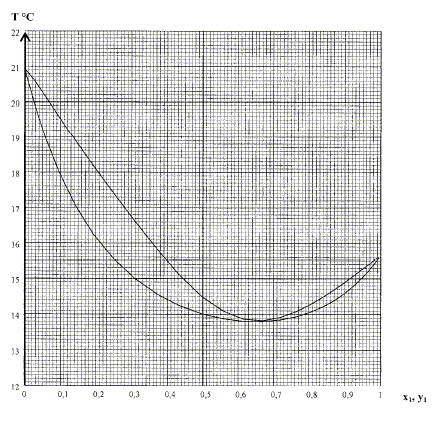
P= 1,0 bar p = 0,1 bar. x1 : fraction molaire du
méthanol dans la phase liquide. y1 : fraction molaire du
méthanol dans la phase gazeuse. Ce n'est pas un mélange idéal : on distingue un azéotrope ; cette situation est fréquente lors de la présence de liaisons hydrogène. Comment nomme t-on le mélange correspondant au minimum dans ces diagrammes ? azéotrope. Calculer la variance d'un système constitué de ce mélange particulier en équilibre avec sa vapeur et commenter la valeur obtenue. A l'azéotrope la phase liquide et la phase vapeur ont la même composition : deux constituants et une relation. Présence de deux phases d'où la variance v = (2-1)+2-2 = 1. La pression étant fixée, le système est invariant. La température d'ébullition, à l'azéotrope, est constante. Commenter le fait que l'abscisse du minimum n'est pas la même dans ces deux diagrammes. La composition de l'azéotrope dépend de la pression fixée.
En vous basant sur les diagrammes binaires et en supposant que les colonnes ont un excellent pouvoir séparateur, quelles sont les compositions du résidu B1 et du distillat D1, si l'alimentation A' a une fraction molaire proche de 0,5 ?
De même, quelles sont les compositions du résidu B2 et du distillat D2 ? Quel est l'intérêt de cette installation par rapport à une distillation classique à une colonne ?
Intérêt : séparation du méthanol et de la butanone. ( impossible à réaliser dans une installation à une colonne). Le débit D2 est égal à 80,8 kmol /h et sa composition en méthanol est xD2 = 0,67. L'alimentation de la seconde colonne a un débit D1= 139,1 kmol/h et sa composition en méthanol est xD1=0,80. Par un bilan de matière global en méthanol calculer le débit de sortie B2 ainsi que sa composition xB2 en méthanol. D1 = B2 +D2 conservation du débit ; B2 = 139,1-80,8 = 58,3 kmol/h. D1 xD1 = B2xB2 + D2 xD2 conservation du méthanol. B2 xB2 = D1 xD1 -D2 xD2 =139,1*0,80 - 80,8*0,67 = 57,1 kmol/h ; xB2 = 57,1 /58,3 = 0,98. L'alimentation de l'ensemble des deux colonnes a un débit A = 100 kmol/h et une composition zA = 0,58 en méthanol. En déduire la composition du résidu de la première colonne xB1 ainsi que le débit B1. Conclure sur l'éfficacité de la séparation. A'=A +D2 = B1 +D1 conservation du débit ; B1 = 100+80,8-139,1 = 41,7 kmol/h. AzA +D2 xD2 =D1 xD1+ B1xB1 + conservation du méthanol. B1 xB1 = AzA +D2 xD2 -D1 xD1= 100*0,58+80,8*0,67 - 139,1*0,80 = 1,08 kmol/h ; xB1 = 1,08/41,7 = 0,026. La séparation est
excellente.
|
|||||||||||||||||
|
|
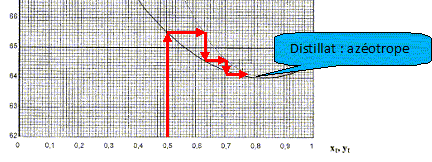 Le
résidu est la butanone.
Le
résidu est la butanone.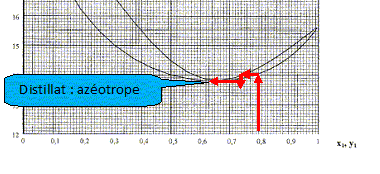 Le
résidu est le méthanol.
Le
résidu est le méthanol.