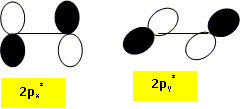|
Le dioxygène : un oxydant particulier, anion superoxyde, radical hydroxyle, oxygène singulet, ozone agrégation 2007. |
||||||||||||||||||
|
||||||||||||||||||
|
Défnition actuelle d'une "oxydation". Au cours d'une oxydation, une espèce chimique cède un ou plusieurs électrons. Quel chimiste français met en vidence expérimentalement la présence de dioxygène dans l'air ? A quelle époque ? Lavoisier en 1774. L'expérience de ce chimiste est décrite comme suit : "122 g de mercure sont placés dans une cornue dont l'extrémité recourbée aboutit à l'intérieur d'une cloche contenant 0,8 L d'air et renversée sur une cuve à mercure. La cornue est mise à chauffer de telle manière à maintenir le mercure en ébullition pendant plusieurs jours. Au bout de 2 jours la surface du mercure commence à se couvrir de paillettes rouges. Après 12 ours, l'épaisseur de la couche de paillettes n'augmentant plus, le chauffage est arrêté. Après refroidissement, les mesures et les observations permettent de dire : - qu'il ne reste plus que 0,66 L " d'air" sous la cloche - que dans l'air restant une bougie s'éteint et une souris meurt, - qu'il s'est formé 2,3 g de "rouille de mercure" ( paillettes rouges) en surface" Le volume molaire des gaz supposés
parfaits est pris égal à 24
L.
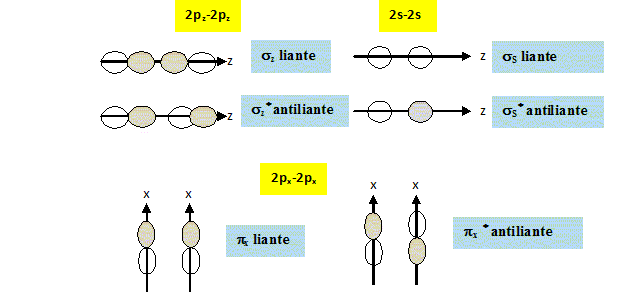
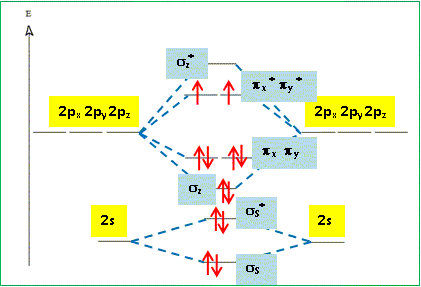
Compléter le diagramme énergétique des orbitales moléculaires fourni. Reporter les lignes en pointillé matérialisant les interactions, indiquer la nature des orbitales atomiques et des orbitales moléculaires et effectuer le remplissage électronique.
Donner la représentation de Lewis de la molécule O2 qui respecte la règle de l'octet ; conclure quant à la validité de cette représentation par rapport aux informations fournies par le diagramme moléculaire.
Le diagramme des orbitales moléculaires
Directement issues de la molécule de dioxygène, diverses espèces réactives (telles que le dioxygène singulet et l’anion superoxyde), sont normalement produites à dose raisonnable et contrôlée par les organismes vivants. Ces espèces et les radicaux libres qu’ils génèrent (radical hydroxyle par exemple), bien qu’indispensables à la vie, sont aussi responsables, en cas de production excessive, de la majorité des dégradations touchant les biomolécules (oxydation des lipides, des protéines, de l’ADN). Cette surproduction est appelée « stress oxydant ». Outre leur implication dans les milieux vivants, les espèces réactives du dioxygène (l’ozone notamment) sont également à l’origine de la dégradation des matériaux plastiques.
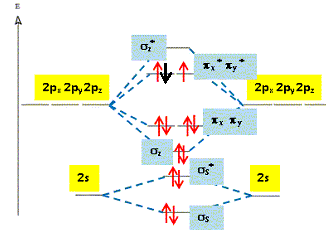
L’anion
superoxyde.
Ce dernier a un électron de plus que la
molécule O2. La structure
électronique de cet anion est donc : ss2
; s*s2
; sz2
; (px2
; py2
) ; (p*x2
; p*y1
) Cette espèce est
quelques fois notée
O2.-.
Justifier cette
écriture. "."
: présence d'un électron
célibataire ; cet in est un
radical "-"
: un électron de valence de plus que
O2. La distance interatomique de l’anion superoxyde est-elle plus petite ou plus grande que celle de la molécule de dioxygène ? Justifier. Indice de liaison dans O2.- : (8-5) / 2 = 1,5 ; indice de liaison dans O2 :(8-4) / 2 = 2 ; dans O2.- la liaison est donc moins forte que dans O2 : en conséquence la distance interatomique est plus grande dans O2.- que dans O2. Dans les milieux vivants, une enzyme (la superoxyde dismutase), catalyse la transformation de l’anion superoxyde en peroxyde d’hydrogène. La réaction mise en jeu est une réaction de dismutation et conduit simultanément à la formation de dioxygène. Ecrire les deux demi -équations redox ainsi que le bilan de la réaction. O2- + 2H+ + e- = H2O2 (1) O2- = O2 + e-(2) par suite : 2O2- + 2H+ = H2O2 +O2. Expliquer le terme « dismutation » en déterminant les degrés d’oxydation de l’élément oxygène dans les différentes espèces mises en jeu.
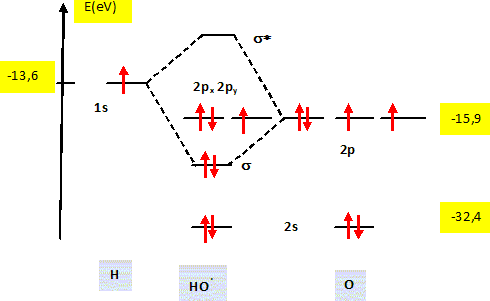
(2) : un atome d'oxygène voit son nombre d'oxydation augmenter de -I à 0 : O2-joue le rôle de réducteur qui s'oxyde. Le radical hydroxyle. Représenter le diagramme énergétique des orbitales moléculaires (en précisant le remplissage électronique) du radical hydroxyle HO• et relier ce diagramme à sa représentation de Lewis.
L’un des modes de formation de ce radical extrêmement réactif impliquerait la réaction : O2.- +H2O2--> O2 + HO- + HO.. La littérature reporte de nombreux commentaires au sujet de cette réaction fortement controversée. On peut notamment relever la phrase suivante : « la réaction n’est pas favorable thermodynamiquement et doit donc être catalysée pour pouvoir avoir lieu ». Commenter cette remarque. Un catalyseur accélère une réaction thermodynamiquement possible ; un catalyseur ne peut rendre possible une réaction thermodynamiquement défavorable : cette remarque est donc fausse. La possibilité d’une catalyse par les complexes du fer (II) selon le mécanisme suivant est également proposée : (1) Fe(II) + H2O2 -->Fe(III) + HO- + HO• (2) O2.- + Fe(III)-->O2 + Fe(II) Quel élément dans ce mécanisme permet de suggérer l’effet catalytique des ions fer (II) ? De quel commentaire supplémentaire faudrait-il l’accompagner pour pouvoir dire qu’il y a effectivement catalyse ? Bilan (1) + (2) :O2.- +H2O2--> O2 + HO- + HO.. Fe(II) apparaît dans le mécanisme de la réaction, mais ne figure pas dans le bilan. Fe(II) est régénéré en fin de réaction. Si les étapes (1) et (2) sont plus rapides que le bilan, alors Fe(II) joue bien le rôle de catalyseur. Le dioxygène singulet. La molécule de dioxygène possède deux états électroniques excités notés 1D1g et 1S +g dont les niveaux d’énergie par rapport à l’état fondamental sont représentés ci-dessous.
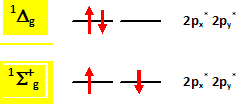
On rappelle que la multiplicité de spin est donnée par a = 2S + 1 où S représente le spin total. L’état fondamental de la molécule de dioxygène est un état triplet. En utilisant le diagramme de orbitales moléculaires, justifier cette assertion et préciser la règle de remplissage électronique qui conduit à cet état triplet. Cet état est-il diamagnétique ou paramagnétique ? La molécule de dioxygène, dans son état fondamental, possède 2 électrons non appariés ( orbitales moléculaires px* py*), avec des spins parallèles : par suite le spin total S vaut 2*½ = 1 ; d'où a = 2S+1 = 2*1+1 = 3 ( état triplet ). La règle de remplissage électronique de Hund conduit à cet état triplet ; la molécule de dioxygène est paramagnétique, conséquence de la présence des deux électrons célibataires. A quoi correspondent les deux états excités 1Dg et 1S +g ? Quelle est leur multiplicité de spin ? On précise que dans l’état 1S +g les deux électrons sont dans des orbitales différentes.
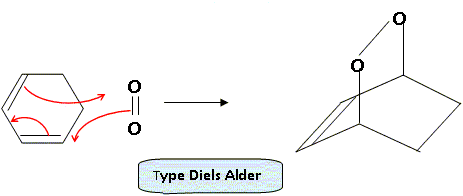
Les électrons ayant des spins anti-parallèles, le spin total S vaut S=0 : d'où a = 2S+1, état singulet. L'état 1Dg a une durée de vie suffisante pour participer à des réactions photosensibilisées impliquées notamment dans les processus biologiques. Sa structure électronique explique par ailleurs un comportement diénophile dans des réactions de cyclo-additions [4 + 2]. Ecrire la réaction entre le dioxygène dans un état 1Dg et le cyclohex-1,3-diène. A quelle réaction cette réaction s’apparente-t-elle ?
Représenter les orbitales « plus haute occupée » (HO) et « plus basse vacante » (BV) du dioxygène dans l’état 1Dg. La plus haute occupée est l'orbitale px* ( ou py*) ; la plus basse vacante est py* ( ou px*).
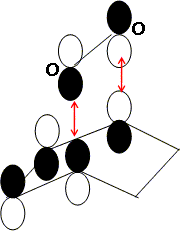
Dans le cadre de l’approximation des orbitales frontières, laquelle de ces orbitales peut interagir avec le cyclohex-1,3-diène au cours de la cyclo-addition évoquée plus haut ? Représenter cette interaction frontalière. Un recouvrement est possible si les orbitales ont la même symétrie.
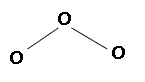
L’ozone fait partie des polluants présents à basse altitude et responsables de la dégradation oxydante des polymères insaturés tels que le polybutadiène. Donner la structure de Lewis de la molécule d’ozone O3 et préciser ses formules mésomères.
Déterminer la géométrie de la molécule d’ozone en nommant et en explicitant la méthode employée. L'atome central est lié à deux autres atomes et compte un doublet non liant, d'où le type AX2E : molécule coudée plane avec un angle voisin de 120°.
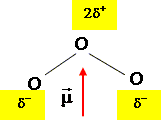
Représenter l’orientation du moment dipolaire de la molécule d’ozone.
Ecrire l’équation de polyaddition 1 – 4 du butadiène conduisant au polybutadiène. n H2C==CH--CH==CH2 ---> --[-CH2--CH==CH--CH2-]-- n. Comment l’ozone peut-il dégrader le polybutadiène ? Préciser le nom de la réaction et la nature des produits formés. ozonolyse sur la double liaison carbone- carbone : il en résulte des composés carbonylés.
|
||||||||||||||||||
|
|