|
Chimie : pH , dosage d'une base forte BTS travaux publics 2008. |
||||||||||||||||||||
|
||||||||||||||||||||
|
On dispose de deux solutions aqueuses de concentration c dans des récipients sur lequels manquent les étiquettes. c = 1. 10-3 mol/L. On dispose également d'étiquettes sur lesquelles sont inscrites les indications suivantes : (H3O+ aq ; Cl- (aq)) et (Na+(aq) ; OH-(aq)). Calculer les pH théoriques d'une solution d'acide chlorhydrique et d'une solution d'hydroxyde de sodium de même concentration c. acide chlorhydrique : pH = - log c = - log 10-3 = 3. hydroxyde de sodium : pH = 14 + log c = 14 + log 10-3 = 11. On désire retrouver par les mesures de pH à quel flacon correspond chaque étiquette. On obtient les mesures suivantes :
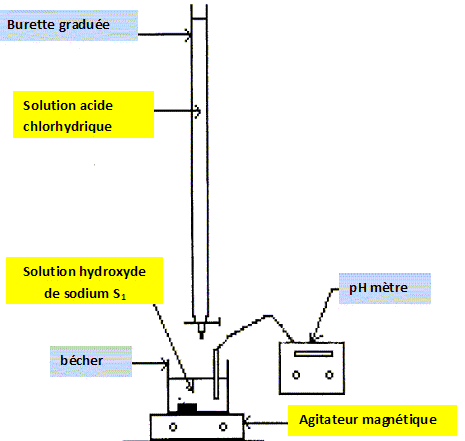
On souhaite déterminer la concentration inconnue d'une solution S0 d'hydroxyde de sodium par un dosage acido-basique. Avant de réaliser le dosage, on prépare une solution S1 par dilution de S0 d'un facteur dix. On dose alors un volume V1 = 10 mL de S1. Pour obtenir l'équivalence, il faut ajouter un volume VE =9,7 mL. Quelle solution de concentration c précédente doit-on utiliser pour réaliser le dosage acido-basique ? La solution d'acide chlorhydrique. Légender le schéma du dispositif expérimental du dosage acido-basique.
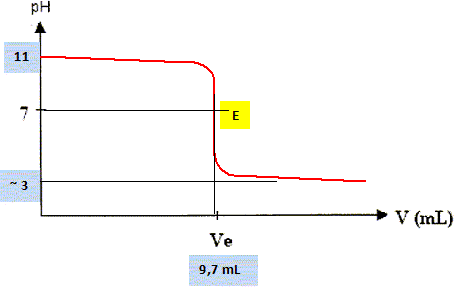
Ecrire l'équation de la réaction acido-basique. OH-(aq) + H3O+ aq = 2 H2O (liq). Donner l'allure de la courbe de dosage en indiquant les valeurs caractéristiques ( pH, volume).
Déterminer la concentration c1 de la solution diluée d'hydroxyde de sodium.
c0 = 10 c1 = 9,7 10-3 mol/L.
|
||||||||||||||||||||
|
|