|
moteur à courant continu, réfrigérateur, alcalinité. BTS FEE 2008. |
|||||||||
|
|||||||||
|
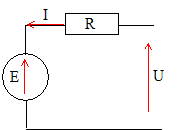
On utilise un moteur à courant continu à excitation indépendante pour entraîner un petit véhicule. Les caractéristiques nominales de ce moteur sont : intensité I du courant dans l'induit : I=IN=110 A ; tension U de l'induit : U=UN=20 V ; vitesse angulaire W de rotation : W =WN=450 rad/s ; résistance R de l'induit : R=0,02 W. Représenter le schéma électrique équivalent de l'induit de ce moteur avec les flèches tension et courant associées.
E étant la force électromotrice du moteur, donner une relation liant U, I, R et E. U= E+R I. Calculer la valeur EN de la force électromotrice induite lorsque le moteur est en fonctionnement nominal. EN = UN-RIN = 20-0,02*110 = 17,8 V. Calculer pour l'induit du moteur en fonctionnement nominal : la puissance électrique Pa reçue : Pa = UNIN= 20*110 = 2200 W = 2,2 kW. la puissance PJ perdue par effet Joule : PJ =RIN2 = 0,02*1102 =242 W. Pem = Pa - PJ
=2200-242 =1956 W ~
1,96 kW.
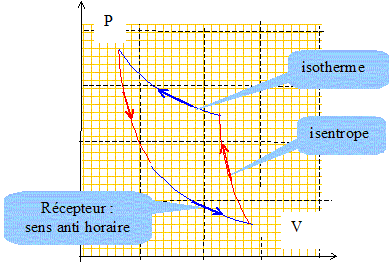
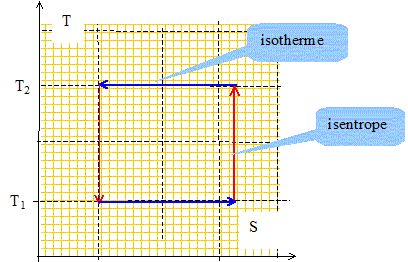
Donner l'allure du cycle de Carnot dans le diagramme p, V (Clapeyron) et dans le diagramme T, S (entropique). Préciser le sens de parcours des cycles Moteur
ditherme de Carnot réversible : Sur le cycle, le 1er principe s'écrit : DU= W+Q1+Q2=0 avec W>0 , travail reçu soit Q1+Q2<0 En appliquant le deuxième principe de la thermodynamique à ce cycle, en déduire une relation entre Q1, Q2 , T1 et T2. Quels sont les signes de Q1, Q2 et W ? Sur le cycle, le 2ème principe s'écrit : DS=0 soit Q1/T1+Q2/T2<=0, relation vérifiée si Q1>0 et Q2<0, T1 étant inférieure à T2. A partir des questions précédentes, établir la relation donnant l'efficacité erév de la machine. Calculer sa valeur numérique. erév =Q1 / W= Q1 /(-Q1-Q2) = 1 / ( -1 -Q2/Q1) avec dans le cas de la réversibilité : Q1/T1 + Q2/T2=0 ; -Q2 /Q1 = T2/T1 ; par suite
erév
= 1
/ ( T2/T1-1) = 1/(300/263-1) =
7,1.
Dans le fonctionnement réel de la machine, on trouve une efficacité qui peut s'écrire sous la forme : eréel = 1 / ( 1,2 T2/T1-1) Calculer la valeur de l'efficacité eréel . eréel =1/(1,2*300/263 -1) = 2,7. Comparer les valeurs des efficacités erév et eréel . eréel < erév . Le cycle éréel est irréversible : les échanges de chaleur ne se font pas à température constante et il faut prendre en compte les frottements.
alcalinité d'une eau. L'alcalinité d'une eau minérale est due essentiellement aux ions hydrogénocarbonates HCO3- qu'elle contient. L'eau minérale d'une bouteille est dosée par une solution d'acide chlorhydrique de concentration ca = 0,02 mol/L . Un chimiste effectué un titrage précis des ions HCO3- dans une prise d'essai de volumeV= 50,0 mL de cette eau minérale. L'équivalence acido-basique est atteinte pour un volume d'acide chlorhydrique versé Ve=14,6 mL . Calculer la valeur du titre alcalimétrique complet (T.A.C.) de cette eau. Rappel : le T.A.C. en degré français (°F) d'une eau est exprimé par le même nombre que le volume en mL d'acide chlorhydrique de concentration ca = 0,02 mol/L qu'il faut ajouter à 100 mL de cette eau pour obtenir 1'équivalence acido-basique en présence d'un indicateur coloré approprié 14,6 mL d'acide versé pour V= 50 mL d'eau ; 29,2 mL pour 100 mL d'eau. 29,2 °F. L'équation associée à la réaction de dosage s'écrit : HCO3- + H3O+ = CO2+ 2H2O les ions H3O+ étant apportés par la solution d'acide chlorhydrique versée. Rappeler la définition de l'équivalence acido-basique. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès, après l'équivalence l'autre réactif est en excès. Calculer la valeur de la concentration molaire C en ions HCO3- de l'eau minérale. C V = ca Ve ; C = ca Ve / V = 0,02*14,6/50 = 5,84 10-3 mol/L.
H : 1,0 ; C : 12 ; O : 16 g/mol Masse molaire HCO3- : M = 1+12+3*16 = 61 g/mol. titre massique ( g/L) = concnetration molaire ( mol/L) * masse molaire (g/mol) = 5,84 10-3*61 =0,356 g/L = 356 mg/L. En accord avec l'indication portée sur la bouteille ( écart : 1*100/356 = 0,3 %) Lorsque l'alcalinité d'une eau est due uniquement aux ions HCO3- , on utilise la correspondance suivante pour le T.A.C. 1°F <-->12,2 mg/L. A partir de cette donnée, retrouver la valeur du T.A.C. de l'eau minérale. 356/12,2 = 29,2°F.
|
|||||||||
|
|
|||||||||
|
|