|
Elimination des ions phosphates, diagrammes de Pourbaix, acides aminés bts métiers de l'eau 08. |
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
|
L'élimination des ions phosphates PO43- des eaux usées peut s'efectuer par une injection de chlorure de fer (III) : FeCl3. Ecrire la formule de Lewis de l'ion phosphate sachant que le phosphore est lié 5 fois. En déduire la géométrie d'après la méthode VSEPR.
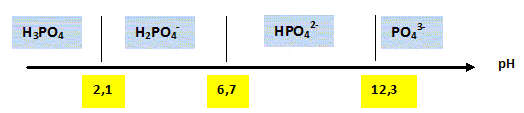
Quel est le nombre d'oxydation du phosphore dans PO43- . n.o(P) + 4*(-2) = -3 ; n.o(P)= V. Les espèces phosphatées se présentent sous diverses formes acido-basiques suivant le pH de la solution ; on donne le pKa de chacun des 3 couples correspondant : pKa( H3PO4, H2PO4-) =2,1 ; pKa(H2PO4-/ HPO42- ) = 6,7 et pKa( HPO42- / PO43- ) =12,3.
Ecrire l'équation de la réaction de précipitation de l'ion phosphate avec l'ion fer (III). Fe3+ + PO43- = FePO4 (s). (1) Dans une eau à pH=7,8, l'espèce prédominante est HPO42-. Justifier simplement pourquoi l'ajout d'une quantité d'ion fer (III) permet l'élimination des différentes espèces phosphatées. HPO42- + HO- = PO43- +H2O (2) La précipitation des ions PO43- ( réaction 1) entraîne le déplacement de l'équilibre acido-basique 2 dans le sens direct ; les ions HPO42- sont donc consommés. H2PO4- + H2O = HPO42- + H3O+ (3) Le déplacement de l'équilibre (2) dans le sens direct entraîne le déplacement de l'équilibre acido-basique (3) dans le sens direct : les ions H2PO4- minoritaires sont consommés. On ne prend pas en compte H3PO4, espèce ultraminoritaire.
Nous cherchons à déterminer la quantité minimale d'ion Fe3+ à ajouter à 100 mL d'une eau à traiter, dont la concentration en phosphore ( que l'on supposera pour simplifier uniquement sous forme de phosphate ) est de 1,6 mg /L, sachant que le norme impose une concentration maximale en phosphore ( toujours sous forme de phosphate) ègale à 1,0 mg/L. On donne les correspondances des concentrations massiques CM(P) en phosphore : CM(P) = 1,6 mg/L correspond à [PO43-]ini = 5,2 10-5 mol/L CM(P) = 1,0 mg/L correspond à [PO43-]fin= 3,2 10-5 mol/L Ecrire la relation de conservation de la quantité ( en moles) des ions phosphate. En déduire la quantité d'ions phosphate qui doit précipiter pour respecter la norme. n(PO43-)ini = [PO43-]ini V avec V= 100 mL = 0,1 L ; n(PO43-)fin = [PO43-]fin V ; On note n la qauntité de matière (mole) d'ion phosphate à traiter pour respecter la norme :
Ks = [Fe3+] [PO43-]. Quelle est la relation entre les quantités de matière d'ion fer(III) et d'ion phosphate qui précipitent ? Fe3+ + PO43- = FePO4 (s). (1) D'après les nombres stoechiométriques de cette équation (1) : n (Fe3+) = n(PO43-). Montrer que la quantité de matière (mole) d'ion Fe3+ restant en solution est négligeable par rapport à la quantité d'ion Fe3+ ayant précipité. On donne Ks = 21,9. ( Ks = 10-21,9). Quantité de matière (mole) d'ion fer (III) ayant précipité : 2,0 10-6 mol. Quantité de matière d'ion fer(III) en solution lorsque la norme est atteinte : [PO43-]fin= 3,2 10-5 mol/L.
2,0
10-6 mol. quel doit être le débit ( L h-1) d'une pompe qui injecte une solution commerciale de chlorure de fer(III) dont la densité est 1,4 et le pourcentage en masse du chlorure de fer (III) est de 42 %. On donne la masse molaire du chlorure de fer(III) : M= 162,5 g/mol. Quantité de matière en phosphate : 2,0 10-6 mol dans 0,1 L soit 2,0 10-5 mol dans 1 L. 100 m3 = 100*1000 = 105 L d'où : 2,0 10-5 *105 = 2,0 mol. Quantité de matière d'ion fer(III) : 2,0 mol. En tenant compte du fait que le technicien en utilise le double : 4,0 mol Concentration de la solution commerciale de chlorure de fer(III) : 1 L a une masse de 1,4 kg = 1400 g et contient 1400*0,42 = 588 g de chlorure de fer(III). Quantité de matière (mol) de chlorure de fer (III) dans 1 L de solution du commerce :
Durée de l'injection : 3 heures
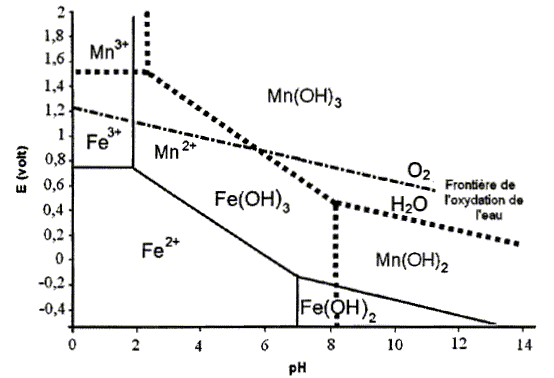
Elimination du fer et du manganèse dissous. On donne les diagrammes de Pourbaix simplifiés du fer et du manganèse. Ces diagrammes sont superposés.
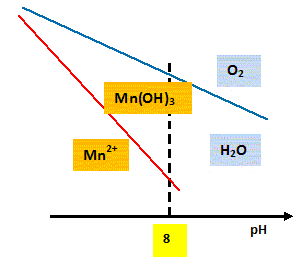
fer : trait plein ; manganèse : pointillés. C = 0,1 mol/L dans les deux cas. L'ion manganèse est-il oxydable par le dioxygène de l'air à pH=8 ? Justifier.
Mn2+ et O2 sont situés dans des domaines distincts ; O2 est situé au dessus de Mn2+ : donc l'ion manganèse (II) est oxydable par O2 à pH = 8. L'ion Fe2+ est oxydable par le dioxygène de l'air quel que soit le pH. Ecrire les demi-équations et l'équation bilan de cette oxydation en milieu basique. A pH >7, le fer(II) est sous forme Fe(OH)2 et le fer(III) sous forme Fe(OH)3. Oxydation : 4 Fe(OH)2 (s)+4 HO- = 4 Fe(OH)3 (s) +4 e-. réduction : O2 + 2H2O + 4e- = 4HO-. 4 Fe(OH)2 (s) + O2 + 2H2O =4 Fe(OH)3 (s). Déduire de ce diagramme la méthode la plus judicieuse et la plus économique pour éliminer les ions Fe2+ et Mn2+ d'une eau à traiter à pH=8. Oxyder l'ion Mn2+ par le dioxygène de l'air en milieu basique : il se forme Mn(OH)3 solide. Oxyder l'ion Fe2+ par le dioxygène de l'air en milieu basique : il se forme Fe(OH)3 solide. Puis filtrer.
Soit un acide aminé H2N-CHR-COOH (R est une chaine carbonée). Ecrire la formule de zwittérion ( ou amphion) de cet acide aminé. H3N+-CHR-COO-. Pour doser une solution d'acide aminé, la méthode de Van Skyke met à profit la réaction de la fonction amine primaire avec l'acide nitreux HNO2. Il en résulte un dégagement gazeux dont on mesure le volume. Ecrire l'équation de la réaction de l'acide aminé ci-dessus avec l'acide nitreux. H2N-CHR-COOH + HNO2 = HO-CHR-COOH + N2(g) + H2O.(3) Sachant que 248 mL de diazote sont recueillis pour 100 mL d'une solution d'acide aminé, quelle est la concentration en acide aminé de cette solution ? On donne le volume molaire des gaz dans les conditions de l'expérience. Vm = 24 L/mol. Quantité de matière (mol), notée n, de diazote :
n= 1,0 10-2 mol d'acide aminé dans V= 0,1 L soit une concentration C égale à :
|
||||||||||||||||||||||||||||||||||||
|
|
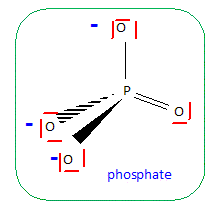 type
AX4,
tétraèdre régulier.
type
AX4,
tétraèdre régulier.