|
Désintégration de l'iode 131, chimie organique : éphédrine. BTS biotechnologie 2008. |
||||||||||||||||||
|
||||||||||||||||||
|
L'iode 131 (13153I ) se désintègre principalement par une radioactivité ß-. Données : Extrait de la classification périodique : 51Sb ; 52Te ; 53I ; 54Xe ; 55Cs. Célérité de la lumière dans le vide : c = 3,00 ×108 m.s-1 ; constante de Planck : h = 6,63 ×10-34 J.s ; 1 u = 1,66 ×10-27 kg ; 1 eV = 1,60 ×10-19 J ; 1 MeV = 1 ×106 eV.
Donner la composition du noyau de l'iode 131. 13153I : 53 protons ; 131-53 = 78 neutrons. Quelle est la nature de la particule ß- ? électron 0-1e. Écrire l'équation de désintégration de l'iode 131, après avoir précisé les lois de conservation utilisées. 13153I ---> AZX +0-1e. conervation de la charge : 53 = Z -1 : Z=54( élément Xe) conservation du nombre de nucléons : 131 =A. 13153I ---> 13154Xe +0-1e. Calcul de l'énergie libérée. Donner l'expression littérale de la perte de masse pour cette désintégration. Dm = m(131 54Xe) + m(ß-) -m(13153I). Dm = 130,905072 +0,000549 -130,906114 = -4,93 10-4 u. 4,93 10-4 *1,66 ×10-27 = -8,184 10-31 kg. En déduire l'expression littérale de l'énergie libérée E1 pour cette désintégration. E1 =[ m(131 54Xe) + m(ß-) -m(13153I)]c2. Calculer la valeur de l'énergie libérée E1 en utilisant les unités du système international, puis donner sa valeur en MeV. E1 =-8,184 10-31*9 1016 =-7,36 10-14 J . -7,36 10-14 /1,60 10-19 = -4,60 105 eV = -0,460 MeV.
Quelle est l'origine du
rayonnement g
? Calculer sa longueur d'onde
l2. Désexcitation du noyau fils. 13154Xe*
-->
13154Xe
+ 0
0g. E2 =
hc/l2
; l2
=hc/E2 =6,63 ×10-34 *3
108 / (0,268*1,6 10-13)
=4,64 10-12
m.
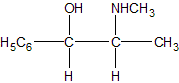
chimie organique. L'éphédrine est une molécule naturelle extraite de l'Éphédra et utilisée depuis 5000 ans par la médecine chinoise. Il s'agit d'un produit dopant et stimulant. L'éphédrine naturelle est la (-) éphédrine ou (1R,2S)-1-phényl-2-(N-méthyl)-aminopropan-1-ol dont la formule semi-développée plane est la suivante :
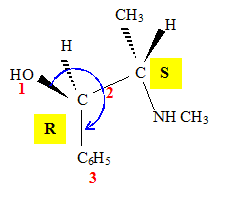
Faire une représentation de Cram (perspective) de la molécule naturelle de configuration (1R,2S) : le carbone numéro 1 sera représenté à gauche. Justifier la représentation faite. Données : Numéros atomiques Z (O) = 8 ; Z (N) = 7 ; Z (C) = 6 ; Z (H) = 1. numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. OH (1) ; CH (CH3) (NHCH3) (2) ; C6H5 (3) ; H (4). On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S). Étude des propriétés optiques de la molécule : Que signifie la notation (-) devant le nom de la molécule ? "qui a la propriété de faire dévier le plan de polarisation de la lumière polarisée dans le sens inverse des aiguilles d’une montre." La loi de Biot est donnée pour une espèce chimique optiquement active en solution dans un solvant inactif par la relation : a = [a].l.C. Donner la signification de chacun des termes de cette loi. a = [a]l, T.C.l a (°) angle de rotation du plan de vibration des ondes lumineuses ; [a] : pouvoir rotatoire spécifique ( ° m2 kg-1 ); C: concentration ( kg m-3 ) ; l : longueur (m) de cuve. Une solution d'éphédrine de concentration massique C = 100 g.L-1 placée dans la cuve d'un polarimètre de longueur 20,0 cm possède un pouvoir rotatoire de (- 120°). Calculer le pouvoir rotatoire spécifique de l'éphédrine en (°.kg.m2). C = 100 g.L-1 = 100 kg m-3 ; l = 0,2 m ; [a] =a /(C.l) =120 /(100*0,2) =6,0 °.kg.m2.
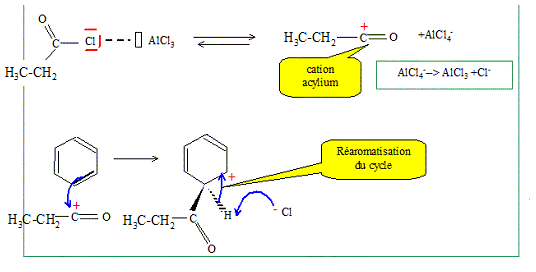
La synthèse chimique de l'éphédrine est réalisée depuis 1923. La première étape consiste à faire réagir du benzène sur le chlorure de propanoyle (CH3-CH2-COCl) en présence de trichlorure d'aluminium (AlCl3). Quel est le rôle de AlCl3 ? AlCl3 joue le rôle de catalyseur. De quel type de réaction s'agit-il ? substitution électrophile, acylatio Friedel et Crafts. Écrire le mécanisme de la réaction.
Écrire l'équation de la réaction. C6H6 + CH3-CH2-COCl --> HCl + C6H5 -CO- CH2-CH3.
|
||||||||||||||||||
|
|
||||||||||||||||||
|
|