|
Elément zinc : atome, radioactivité de 62Zn ; conductivité ; pile et produit de solubilité Chimie de laboratoire 2008. |
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
L'atome de zinc : Donner la structure électronique de l'atome de zinc dans son état fondamental. Z=30 : 30 électrons répartis de la manière suivante : 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Préciser à quel bloc d'éléments ( s, p, d, f) de la classification périodique appartient le zinc. 1ère série d'éléments de transition ( bloc d). Indiquer la position exacte ( ligne, colonne) du zinc dans la classification périodique. 4ème ligne, colonne 12. Donner la structure électronique de l'ion zinc Zn2+. 1s2 2s2 2p6 3s2 3p6 3d10. Radioactivité : Indiquer la composition
du noyau de zinc 62. 30 protons ;
62-30 = 32
neutrons. Préciser la
nature de la radioactivité
b+. positon
01e.
Données
: Potentiel standard : E°(Zn2+/Zn)=-0,76 V ; E°(Fe3+/Fe2+)=+0,77V ; RT/F = 0,06 V. Conductivité molaire ionique de l'ion zinc(II). On considère une solution S à 25 °C obtenue par dissolution d'une masse m= 0,140 g de nitrate de zinc hexahydraté Zn(NO3)2, 6H2O dans le volume d'eau nécessaire pour obtenir un volume V= 500 mL de solution. On mesure la conductivité s de la solution S. s = 23,4 10-3 S m-1. On suppose que la solution S est suffisamment diluée pour que l'on puisse considérer que les conductivités molaires ioniques soient utilisable. Déterminer la concentration C de la solution S en mol/L puis en mol m-3. n(mol) = m(g) / M( g/mol) ; M(Zn(NO3)2, 6H2O)= 65,4 + 2*(14+3*16) + 6*18 =297,4 g/mol ; n = 0,140/297,4 = 4,707 10-4 mol. C(mol/L)= n(mol) / V(L) ; C =4,707 10-4 /0,5 =9,41 10-4 mol/L = 0,941 mol m-3. La solution est électriquement neutre : 2
[Zn2+] =
[NO3-] [Zn2+]
=C et
[NO3-]
= 2C. . Donner la relation entre la conductivité s de la solution S, les conductivités molaires ioniques l°NO3- et l°Zn2+ et les concentrations des ions . s = l°Zn2+[Zn2+] + l°NO3- [NO3-]. En déduire la valeur de l°Zn2+ . s = l°Zn2+C + l°NO3- 2C ; l°Zn2+ = s /C-2l°NO3-. l°Zn2+ = 23,4 10-3 /0,941-2*7,14 10-3 =10,6 10-3 S m2 mol-1.
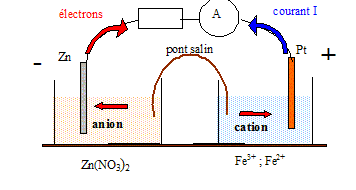
Pile et produit de solubilité. On réalise à 25°C une pile électrochimique de la manière suivante : Compartiment 1 : 100 mL d'une solution de nitrate de zinc(II) de concentration 1,0 10-2 mol/L dans laquelle plonge une lame de zinc métallique. Cet ensemble constitue l'électrode de zinc ( potentiel E1). Compartiment 2 : 100 mL d'une solution contenant des ions fer(II) de concentration 1,0 10-2 mol/L et des ions fer (III) de concentration 5,0 10-3 mol/L dans laquelle plonge un fil de platine. Cet ensemble constitue l'électrode de platine ( potentiel E2). Les deux compartiements sont reliés par un pont ionique. On mesure la différence de potentiel entre les deux électrodes avec un voltmètre. Exprimer puis calculer les potentiels E1 et E2. Zn = Zn2+ + 2e- : E1 = E°(Zn2+/Zn) + 0,06/2 log[Zn2+]. E1 = -0,76 +0,03 log 1,0 10-2 = -0,76 - 0,06 ; E1 = -0,82 V. Fe2+= Fe3++ e- : E2 = E°(Fe3+/Fe2+) + 0,06 log[Fe3+]/[Fe2+]. E2 = +0,77 +0,06 log (5 10-3/1,0 10-2 )= 0,77 - 0,018 ; E2 = 0,75 V. En déduire les polarité de la pile : L'électrode de zinc constitue la borne négative de la pile. Faire un schéma annoté de la pile en précisant le sens du courant et le sens du déplacement des électrons lorsque la pile fonctionne.
Calculer la force électromotrice E de la pile. E = E2-E1 = 0,75-(-0,82) =1,57 V ~ 1,6 V.
Ecrire l'équation de la réaction des ions Zn2+ avec les ions CO32-. Zn2+ +CO32- = ZnCO3(s). Exprimer E'1 en fonction de E2 et E' puis calculer le nouveau potentiel E'1 de l'électrode de zinc. En déduire la concentration résiduelle en ion Zn2+ dans le compartiment 1. E'= E2-E'1 ; E'1= E2-E'= 0,75-1,67 ; ; E'1= -0,92 V. E'1 = E°(Zn2+/Zn) + 0,03 log[Zn2+]résiduelle. log[Zn2+]résiduelle = ( E'1 - E°(Zn2+/Zn) )/ 0,03 =(-0,92-(-0,76)/0,03 =-5,33 [Zn2+]résiduelle =4,64 10-6 mol/L~ 4,6 10-6 mol/L. Montrer que la concentration en ion carbonate dans le compartiment 1 est égale à la concentration résiduelle en ion Zn2+ dans ce compartiment. D'une part les quantités de matière initiale en ion Zn2+ et ion CO32- sont identiques. D'autre part une mole d'ion Zn2+ réagit avec une mole d'ion CO32-. Donner l'expression littérale du produit de solubilité Ks du carbonate de zinc puis calculer sa valeur à 25 °C. Ks =[Zn2+]résiduelle [CO32-]résiduelle = 4,64 10-6 *4,64 10-6 =2,15 10-11~2,2 10-11.
|
||||||||||||||||||||||||||||||||
|
|