|
Chimie bac STL biologie, génie biologique 2008. déterminer la constante d'acidité du couple acide éthanoïque / ion éthanoate par deux méthodes différentes. |
||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||
|
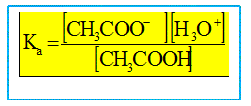
On souhaite déterminer la constante d'acidité du couple acide éthanoïque / ion éthanoate par deux méthodes différentes. Détermination du pKa par mesures ponctuelles de pH. Ecrire l'équation de la réaction de l'acide éthanoïque avec l'eau. Les couples acide / base mis en présence sont : CH3COOH / CH3COO- et H3O+ / H2O. CH3COOH + H2O = CH3COO- + H3O+. Donner l'expression de la constante d'acidité Ka associée.
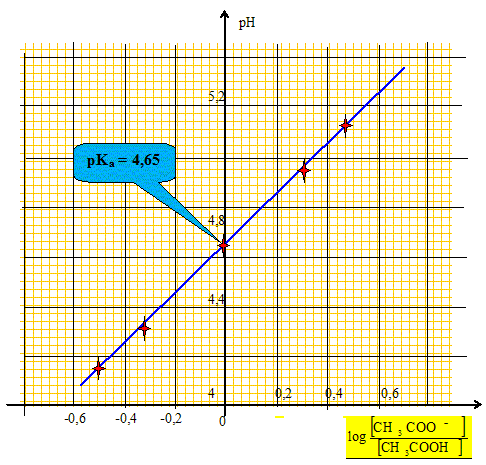
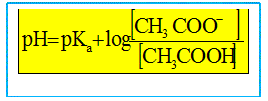
Ce graphe est-il compatible avec la relation (2) donnée ci-dessus. En déduire la valeur du pKa du couple étudié.
Le graphe est une droite de pente égale à 1 et d'ordonnée à l'origine a=pKa: il est compatible avec la relation (2).
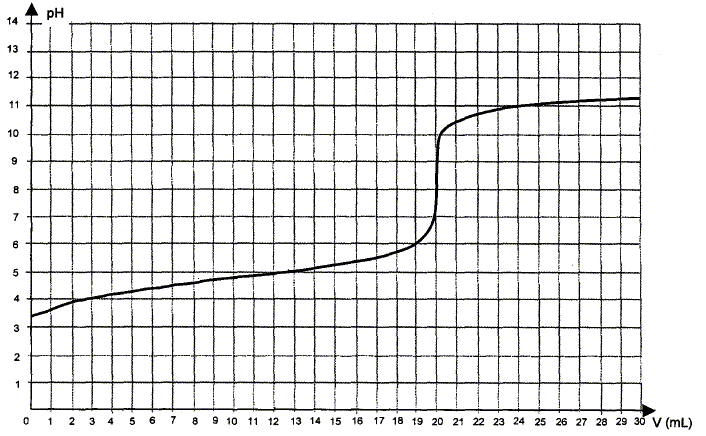
Utilisation d'une courbe de titrage. La courbe obtenue lors du titrage de la solution d'acide éthanoïque par une solution d'hydroxyde de sodium ( soude) est donnée ci-dessous. On appelle VE le volume de solution d'hydroxyde de sodium versé à l'équivalence.
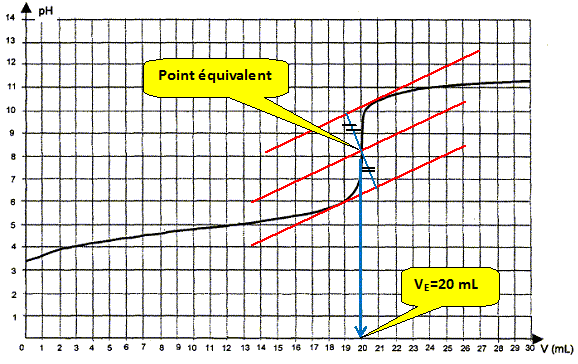
Ecrire l'équation de la réaction de titrage. Les couples acide / base mise en présence sont : CH3COOH / CH3COO- et H2O / HO- . CH3COOH + HO- = CH3COO- + H2O. Déterminer graphiquement la valeur du volume VE de solution de soude versé à l'équivalence.
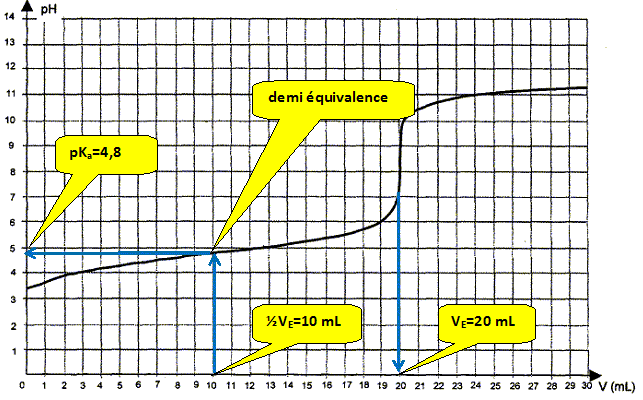
Quelle proportion d'acide éthanoïque est dosé à la demi-équivalence ? On note ni la quantité de matière (mole) d'acide éthanoïque initial. A la demi équivalence la moitié de l'acide éthanoïque initial est dosé : il reste ½ ni mole d'acide éthanoïque et il s'est formé ½ ni mole d'ion éthanoate. En déduire la relation entre pH et pKa à la demi équivalence. En conséquence log [CH3COOH ]/[CH3COO-] = log 1 = 0 et la relation (2) donne pH=pKa.
valeur moyenne des deux déterminations : (4,8+4,65) /2 = 4,72 écart relatif entre les deux valeurs : (4,8-4,65) *100 / 4,72 =3,2 %. A 3,2 % près les valeurs sont identiques.
|
||||||||||||||||||||||||||||||||||||||||||
|
|
 (2)
(2)