|
Chimie bac STL physique de laboratoire et procédés industriels 2008. Dosage des ions chlorure dans l'eau de mer ; protection d'un bateau contre l'effet de l'eau de mer |
||||||
|
||||||
|
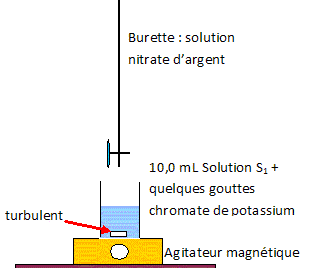
Le chlorure de sodium est extrait de l'eau de mer. Il se récolte dans les marais salants par évaporation de l'eau. La teneur moyenne des océans en chlorure de sodium est de 35 g/L. On se propose de vérifier cette concentration massique en dosant les ions chlorure de l'eau de mer par la méthode de Mohr. Préparation de la solution : On désire préparer V = 100 mL deau de mer diluée 10 fois ( solution S1). Déterminer le volume d'eau de mer à prélever pour préparer la solution. volume de la solution fille / facteur de dilution =100/10 = 10 mL. Donner la verrerie à utiliser. Fiole jaugée de 100 mL, pipette jaugée de 10,0 mL On introduit dans un
erlenmeyer une prise d'essai V1 = 10,0
mL de la solution S1. On ajoute environ
20 mL d'eau distillée et quelques gouttes de
chromate de potassium (2K+ +
CrO42-). On dose la solution
avec une solution de nitrate d'argent
(Ag+ + NO3-) de
concentration molaire C2 = 5,0
10-2 mol/L.
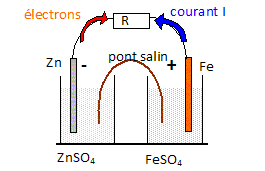
On réalise une pile à partir de 2 demi-piles obtenues avec les couples Fe2+/Fe et Zn2+/Zn. E(Zn2+/Zn) = -0,76 V ; E(Fe2+/Fe) = -0,44 V ; E(Ni2+/Ni) = -0,23 V. Justifier à partir des potentiel d'oxydoréduction que l'quation de la réaction modélisant le fonctionnement de la pile est la suivante : Zn + Fe2+ --> Fe + Zn2+. Le zinc est plus réducteur que le fer : le zinc s'oxyde ; l'ion Fe2+ est un oxydant plus fort que Zn2+ : Fe2+ se réduit. Ecrire les demi équations des réactions qui se produisent à chaque électrode lorsque la pile débite. Zn = Zn2+ + 2e- ; Fe2+ + 2e- =Fe. Faire un schéma légendé de cette pile. Indiquer la polarité des électrodes et le sens de circulation des électrons quand la pile débite dans une résistance.
Quelle est l'espèce oxydée ? Quelle est l'espèce réduite ? Le réducteur Zn s'oxyde ; l'oxydant Fe2+ se réduit. Quelle est la polarité de la cathode, électrode où se produit une réduction ? La réduction de Fe2+ nécessite l'apport d'électrons : ces derniers sont libérés à l'anode négative ; les électrons gagnent ensuite la cathode positive par le circuit extérieur.
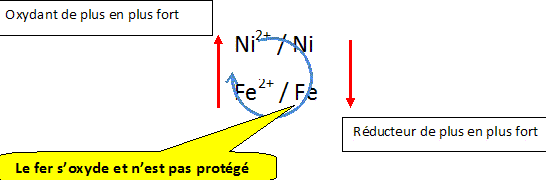
On parle de corrosion pour définir la transformation subie par les métaux lorsqu'ils sont oxydés et passent à l'état d'ions. Cette attaque de métaux se fait par l'intermédiaire d'agents présents dans le milieu où ils se trouvent : agents atmosphériques, eau de mer... Afin de protéger les métaux, on peut mettre en oeuvre une protection éllectrochimique : un métal ne peut pas s'oxyder si l'on fait en sorte qu'il soit la cathode d'une pile. La corrosion du fer représente le cas le plus important en raison des innombrables utilisations des matériaux ferreux, fer, fontes et aciers ( carrosseries, coques de navires...). Pour protéger la coque en acier ( que l'on supposera se comporter comme du fer) des bateaux, on fixe sur celle-ci des plaques en métal afin de constituer une pile. La coque du bateau est-elle protégée si la plaque est en nickel ? Justifier.
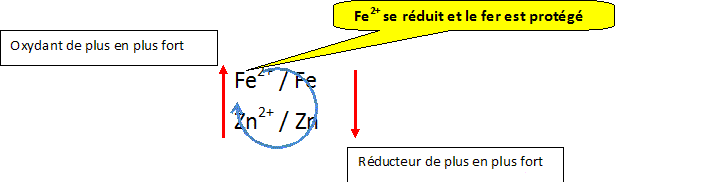
La coque du bateau est-elle protégée si la plaque est en zinc ? Justifier.
Conclusion. Pour protéger la coque en acier des bateaux, on fixe sur celle-ci des plaques en zinc ou en magnésium.
|
||||||
|
|