|
eau oxygénée ; triglycérides ; statique des fluides bac SMS Réunion 2007. |
|||||||||||||||||||
|
|||||||||||||||||||
|
L'eau oxygénée est un antiseptique grâce à l'action oxydante du peroxyde d'hydrogène H2O2. Celui-ci se décompose lentement à température ordinaire. Les deux demi-équations électroniques concernées par la réaction mise en jeu sont : H2O2 + 2 H+ + .... = 2H2O (1). H2O2 = O2 +2 H+ + 2 e- (2). Compléter la première demi-équation. H2O2 + 2 H+ +2 e- = 2H2O (1). Ecrire le couple redox associé à chaque demi-équation et préciser le nom de l'espèce qui joue le rôle d'oxydant dans chacun des couples. Dans l'écriture d'un couple redox, l'oxydant est écrit en premier : (1) H2O2 (peroxyde d'hydrogène) / H2O. (2) O2 (dioxygène) / H2O2. (1) + (2) donne : H2O2 +
H2O2 + 2 H+
+2 e- =
2H2O +O2 +2 H+ + 2
e- après simplification :
2
H2O2 = 2H2O
+O2.
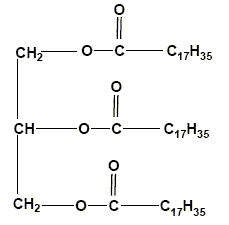
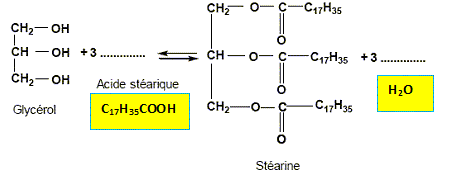
Triglycérides. Qu'est ce qu'un triglycéride ? triester du glycérol. La stéarine est un triglycéride de formule
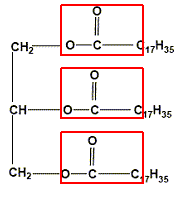
semi-développée plane : Ce triglycéride est obtenu par action du glycérol sur l'acide stéarique. Dans la formule semi-développée de la stéarine, entourer les groupes fonctionnels ester
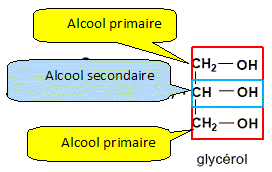
L'acide stéarique est-il un acide gras saturé ou insaturé ? Justifier. acide stéarique : C18H36O2 ; Une chaîne carbonée comptant 18 atomes de carbone est saturée si elle compte 36 atomes d'hydrogène. Entourer le ou les groupes fonctionnels qui caractérise(nt) le glycérol en précisant leu(s) nom(s).
Les triglycérides peuvent être dosés dans le sérum sanguin. Après avoir effectué une hydrolyse des triglycérides ( réaction inverse de celle étudiée ci-dessus), on dose la quantité de glycérol libéré. La triglycéridémie est normale lorsque le taux est compris entre 0,6 et 1,5 g par litre de sérum. Un dosage a permis de montrer chez un patient la présence de 8,7 10-5 mol de glycérol pour un prélevement de 10 mL de sérum. Quelle quantité de matière n1 se trouverait dans 1 L de sérum ? Dans 1 L il y a 1000 mL soit 100 fois 10 mL d'où n1 = 100* 8,7 10-5 = 8,7 10-3 mol. Déterminer la masse m1 correspondante de glycérol. masse molaire du glycérol M= 92 g/mol. m = n M ; m = 8,7 10-3*92 = 0,80 g. La triglycéridémie de ce patient est-elle normale ? Justifier. m1 est compris entre 0,6 et 1,5 g/L : la triglycéridémie de ce patient est donc normale.
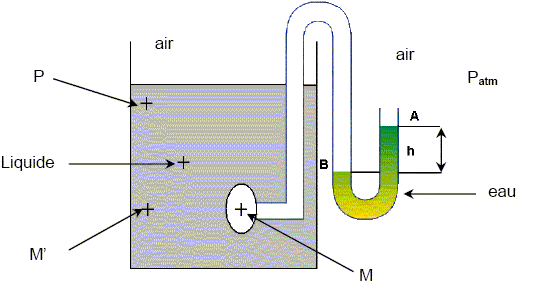
Statique des fluides. Une capsule manométrique reliée à un tube en U contenant de l'eau est plongée dans un récipient contenant un liquide.
La différence de pression entre deux points A et B d'un liquide au repos est donnée par la relation : pB-pA = r g h avec g = 9,8 N/kg. Que représentent les lettres r g h ? r : masse volumique de l'eau dans ce cas. g : champ de pesanteur terrestre au niveau du sol. h : différence d'altitude entre les points A et B. Préciser les unités SI de pB ou pA et h. pB ou pA : pression en pascal( Pa) ; h : hauteur en mètre(m) On dispose de 4 liquides dont on connaît les masses volumiques
Calculer la masse volumique du liquide et en déduire sa nature. r =( pB-pA) /( g h) avec h = 0,1 m. 774/(9,8*0,1) =790 kg m-3, donc alcool.
pB = 774 +pA = 774+105~1,008 105 Pa . Cette pression pB est aussi celle qui règne au point M. On déplace la capsule manométrique au point M' situé dans le même plan horizontal que le point M. Comparer les pressions aux points M et M'. Justifier. La différence d'altitude entre les points M et M' est nulle ( M et M' sont dans le même plan horizontal) donc h=0 et en conséquence pM = pM'. On déplace la capsule manométrique au point P. La pression en P est-elle inférieure, égale ou supérieure à celle mesurée en M ? Justifier sans calcul. Le point P est situé au dessus du point M. La pression en un point d'un liquide est d'autant plus grande que la profondeur augmente. La pression en P est donc inférieure à la pression en M.
|
|||||||||||||||||||
|
|