|
eau de Javel ; savon ; champ magnétique bac SMS Polynésie 09/ 2007. |
|||||||||
|
|||||||||
|
On considère un berlingot d'eau de javel de volume V= 250 mL; le degré chlorométrique est t= 48°chl. L'étiquette met en garde l'utilisateur sur les risques encourus lors de l'emploi de l'eau de javel : " au contact d'un acide, dégage un gaz toxique". Compléter l'équation de la transformation chimique correspondant au dégagement gazeux toxique évoqué. ClO- + Cl- + .... H+ = Cl2 + H2O. Bilan de matière sur l'élément hydrogène : ClO- + Cl- + 2 H+ = Cl2 + H2O. Donner le nom et la formule chimique de ce gaz toxique. Cl2 : dichlore. Les réactions d'oxydoréduction correspondent à des échanges d'électrons entre espèces chimiques. On rappelle ci-dessous les demi-équations électroniques relatives aux couples oxydant / réducteur liés à l'eau de Javel : 2ClO- + 4H+ +2 e- = Cl2 + H2O. 2Cl- = Cl2 +2 e-. ClO-
/
Cl2
et
Cl2 /
Cl-. Quel
est la formule de l'ion responsable des
propriétés oxydantes de l'eau de
javel
? ClO-
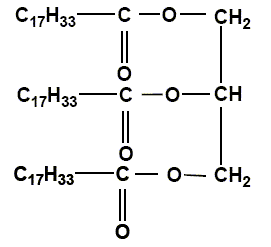
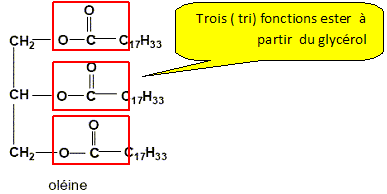
Savon. Les savons sont préparés à partir des triglycérides ou corps gras comme l'oléine représentée ci-dessous :
Qu'est ce qu'un triglycéride ? un triester du glycérol. Entourer les groupes fonctionnels caractéristiques "ester".
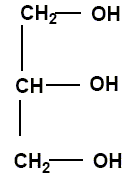
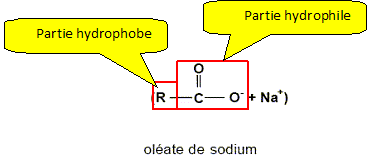
1 mole oléine + 3 moles d'hydroxyde de sodium = 3 moles d'oléate de sodium +A. L'oléate de sodium est un savon de formule C17H33COO- + Na+. Le produit A a pour formule
semi-développée :
Sur la formule du savon, identifier la partie hydrophile de l'ion carboxylate.
Quel esl le nom de cette réaction de formation du savon ? saponification, hydrolyse basique. Donner le nom du produit A. Glycérol. On veut fabriquer un savon à partir d'une masse m = 300 g d'oléine. la masse molaire de l'oléine est M=884 g/mol. Montrer que la quantité de matière n d'oléine correspondante à la masse m est n=0,340 mol. n=m / m ; n = 300/884 = 0,340 mol. En utilisant l'équation chimique montrer que la quantité minimale de soude ( ou hydroxyde de sodium) nécessaire est n' = 1,02 mol. A partir d'une mole d'oléine il faut 3 moles de soude : n'=3 n = 3*0,340 = 1,02 mol.
Champ magnétique. On place une boussole sur l'une des tables d'une salle de TP. L'aiguille aimantée s'immobilise selon une certaine direction du fait du champ magnétique terrestre. Quel est le nom et le symbol de l'unité du champ magnétique ? tesla (T). Donner un ordre de grandeur du champ magnétique terrstre. 10-5 T . Faire un schéma où apparaitront l'aiguille aimantée et le vecteur champ magnétique en ce lieu.
Sur cette même table,on réalise un circuit électrique comprenant : un générateur de courant continu, un solénïde, un ampèremètre et une lampe à incandescence. A l'aide d'un teslamètre et de sa sonde on mesure l'intensité du champ magnétique à l'intérieur du solénoïde. Le tslamètre affiche la valeur : 2,80 sans préciser l'unité. Connaissant l'ordre de grandeur des valeurs usuelles des champs magnétiques, choisissez la valeur plausible du champ magnétique ainsi mesuré, exprimé dans le système SI. 2,80 106 ; 2,80 103 ; 2,80 ; 2,80 10-3. La valeur du champ est de l'ordre du millitesla, d'où : 2,80 10-3 T.
Sous l'action d'un champ magnétique intense les noyaux d'hydrogène ( abondants dans l'organisme) réagissent à une onde excitatrice ; il y a résonance. Chacun de ces noyaux émet un signal ; l'ensemble est collecté et traité par un ordinateur qui fournit une image. Indiquer la composition du noyau d'hydrogène 11H ( neutrons et protons ). 1 proton ; 1-1 = 0 neutron. Quelle est l'énergie E d'un photon associé à une onde radio excitatrice de fréquence n=60,4 106 Hz ? constante de Planck : h = 6,62 10-34 Js. E = h n. E = 6,62 10-34 *60,4 106 =4,0 10-26 J.
|
|||||||||
|
|
 .
.
 avec
R identifié à :
C17H33
avec
R identifié à :
C17H33