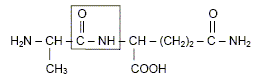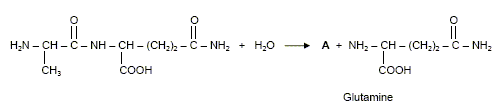|
synthèse peptidique ; eau de Javel ; radioactivité : césium 137 bac SMS France septembre 2006. |
||||||||
|
||||||||
|
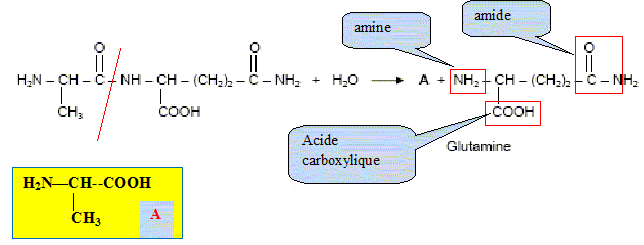
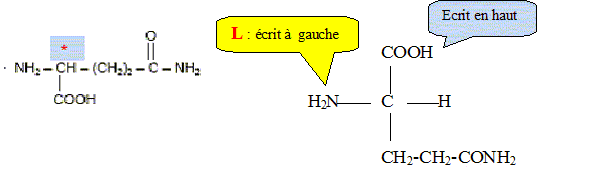
Dans des circonstances normales, l’organisme produit de la L-glutamine dont il a besoin pour fabriquer ses protéines. Selon certains nutritionnistes, un stress de longue durée comme celui causé par l’infection du VIH peut faire en sorte que les besoins en glutamine de l’organisme excèdent sa capacité à la produire. Il s’en suit alors une fonte musculaire. Pour prévenir et renverser cet effet, un apport en glutamine est nécessaire. Il faut donc utiliser des préparations susceptibles de libérer de la glutamine dans l’organisme. C’est le cas du dipeptide alanine-glutamine. Formule du dipeptide alanine-glutamine :
Préciser le nom du groupe caractéristique encadré. Amide ou liaison peptidique. L’hydrolyse acide de ce dipeptide libère de la glutamine ainsi qu’un produit A. L’équation de la réaction est la suivante :
A quelle famille
chimique appartient la glutamine ? Justifier la
réponse. acide a-aminé
: groupes amine et acide carboxylique portés
par le même carbone.
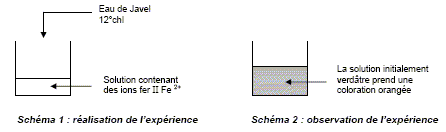
L'eau de Javel. Données : En solution dans l’eau, les ions fer II, Fe2+, sont de couleur verte et les ions fer III, Fe3+, sont de couleur rouille. L’eau de Javel est un désinfectant bactéricide, sporicide, fongicide et virucide (hépatite et VIH). L’eau de Javel fait partie des oxydants chlorés. Afin de montrer les propriétés oxydantes de l’eau de Javel, des élèves, au cours d’une séance de travaux pratiques, ont fait réagir de l’eau de Javel avec une solution contenant des ions fer II, Fe2+. Les schémas résumant l’expérience et son observation sont donnés cidessous :
Les demi-équations électroniques relatives aux couples oxydant / réducteur intervenant dans cette réaction sont : Fe2+ =Fe3+ + e- (1) ; 2e- + CIO- + H2O = Cl- + 2 HO-. A partir des deux demi-équations électroniques, retrouver l’équation de la réaction qui a lieu. (1) s'écrit : 2Fe2+ =2Fe3+ +2 e- 2e- + CIO- + H2O = Cl- + 2 HO- ; ajouter : 2Fe2+ + 2e- + CIO- + H2O = 2Fe3+ +2 e- + Cl- + 2 HO- ; simplifier : 2Fe2+ + CIO- + H2O = 2Fe3+ + Cl- + 2 HO-. A quoi est due l’apparition de la couleur rouille dans le bécher ? Formation des ions Fe3+. Oxydation des ions Fe2+ en ion Fe3+.
Cet ion intervient-il
en tant qu’oxydant ou
réducteur ? Cet ion gagne des électrons : c'est un
oxydant
; il se réduit. . - pipette jaugée de 25 mL, becher, éprouvette graduee de 100 mL, fioles jaugées de 500 mL, 200 mL et 100mL, propipette. Définir le degré chlorométrique °chl d'une eau de Javel. On appelle degré ou titre chlorométrique d'une eau de Javel le volume de dichlore, mesuré en litres dans les conditions normales de température et de pression, nécessaire à la fabrication d'un litre de cette eau de Javel. Combien de fois faut-il diluer la solution de Javel de la dose recharge pour passer de 48°chl à 12°chl ? 48/12 = 4 fois. A quoi sert la pipette jaugee de 25 mL ? Prélever un volume précis ( 25 mL) de la solution concentrée à 48°chl. Pourquoi utilise-t-on une propipette ? Aspirer la solution concentrée dans la pipette jaugée. Dans quel recipient ont-ils effectué la dilution ? Donner son nom et son volume. Fiole jaugée de 100 mL.
Radioactivité : césium 137. Le césium, de symbole Cs, est un élément comportant plusieurs isotopes dont le césium 137 radioactif b-. Qu'appelle-t-on des isotopes ? Deux isotopes ne se différencient que par leur nombre de neutrons ; ils ont le même numéro atomique Z. Donner le nombre de protons et de neutrons du noyau 13755Cs. Z= 55 protons ; 137-55 = 82 neutrons. Lors de désintegrations radioactives, différents types de particules peuvent être émises : 42He , 0-1e, 01e. Indiquer la particule émise lors de la désintegration b- du césium 137. électron 0-1e. Ecrire l'équation de la désintégration d'un noyau de césium 137 sachant que, outre la particule b-, on obtient un noyau de baryum 13756Ba. 13755Cs -->13756Ba +0-1e. La période radioactive du césium 137 est T = 30 ans. L'ovaire d'une femme de Tchernobyl, agée de 25 ans, a fixé une masse m0 = 1 mg de cesium 137. Definir la période radioactive (ou demi-vie) T d'un radionucleide. Durée au bout de laquelle l'activité initiale est divisée par 2 ; durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. Sachant que cette femme était agée de 25 ans au moment de l'irradiation, quelle sera la masse m1 de cesium 137 encore fixee sur l'ovaire quand elle aura 55 ans ? 55-25 = 30 ans : au bout d'une demi-vie la moitié des noyaux initialement présents se sont désintégrés ; il reste donc la moitié de la masse initiale de césium 137 soit m1 = 0,5 m g. Au bout de combien de temps peut-on considérer un échantillon de césium 137 comme inactif ? Au bout d'environ 8 périodes ou demi-vie ; soit environ 8*30 = 240 ans.
Dans les hôpitaux, le césium 137 est utilisé pour traiter les lésions sous-cutanées. Le personnel de certains services est donc amené à manipuler des substances radioactives. Sans protection, il subirait des irradiations répétées pouvant conduire à des risques de maladies graves. Citer deux effets néfastes sur le corps humain d’une dose d’irradiation importante. Les particules ionisantes et le rayonnement g sont capables de provoquer des réactions chimiques et des modifications dans la structure des molécules constituant la matière vivante. En particulier, ils peuvent induire des mutations génétiques lorsque l'ADN se trouve modifié. Malaises, vomissements, nausées, diarrhée, anorexie, grande fatigue ; modification de la formule sanguine Citer un moyen de protection pour les personnels médicaux manipulant les radioéléments. -mettre un ou plusieurs écrans entre la source de rayonnements et les personnes. ( murs de béton, des parois en plomb). - diminuer au maximum la durée de l’exposition aux rayonnements.
|
||||||||
|
|