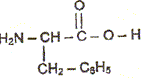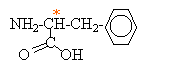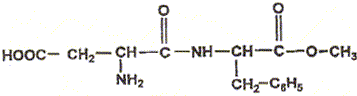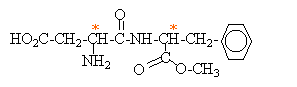|
Aspartame ; eau de Javel ; radioactivité : l'iode bac SMS Nouméa 11/07 |
||||||
|
||||||
|
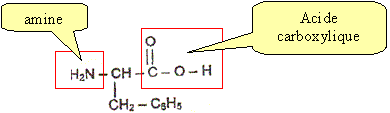
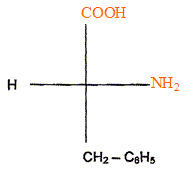
L'aspartame est un édulcorant appelé " sucrette". Lors de la digestion, l'aspartame s'hydrolyse dans l'estomac. Les produits de la réaction sont deux acides a-aminés ( dont la phénylalanine) et du méthanol. La formule
semi-développée de la phénylalanine est
: Entourer et nommer les groupes fonctionnels que vous connaissez. Cette molécule est-elle un acide a-aminé ou un dipeptide ? Justifier. On retrouve le groupe d'atomes caractéristiques d'un acide aminé : . On ne retrouve pas le groupe d'atomes caractéristiques d'une liaison peptidique :
L'eau de Javel. 6 pts On appelle degré ou titre chlorométrique d'une eau de Javel le volume de dichlore, mesuré en litres dans les conditions normales de température et de pression, nécessaire à la fabrication d'un litre de cette eau de Javel. Dans ces conditions le volume molaire des gaz est Vm=22,4 L/mol. On considère un berlingot d'eau de Javel titrant 48 °chl. Quel est le volume de dichlore que peut libérer ce berlingot ? 48 °chl soit 48 L de dichlore libérés par 1 L d'eau de Javel. Or 250 mL = 0,25 L = un quart de litre : d'où 48/4 = 12 L. On dilue la solution contenue dans le berlingot en la versant dans 750 mL d'eau. On obtient ainsi 1 L d'eau de Javel diluée prête à l'emploi. Quel est le degré chlorométrique de cette eau de Javel diluée ? facteur de dilution F = volume de la solution diluée / volume du berlingot ; F = 4. La solution finale étant 4 fois moins concentrée que la solution du berlingot, son degré chlorométrique est : 48/4 = 12 °chl. La totalité de ce berlingot est mélangée par inadvertance avec un détartrant contenant de l'acide chlorhydrique. L'équation bilan de la réaction est : Cl- + ClO- + 2H+ donnent Cl2 + H2O.(1) Préciser le nom du gaz toxique qui se dégage. Dichlore Cl2. On admet que la totalité des ions hypochlorite ClO- présents dans le berlingot, soit n=0,54 mol ont réagi avec l'acide chlorhydrique. Quel volume de gaz s'est-il dégagé ? D'après les nombres stoechiométrique de l'équation (1) : n(Cl2) = n(ClO-) = 0,54 mol. Volume d'un gaz ( L) = quantité de matière (mol) * volume molaire ( L/mol) V = n * Vm = 0,54*22,4
=12 L.
Dans une solution d'iodure de potassium ajoutons quelques gouttes d'eau de Javel. Les deux couples oxydant / réducteur intervenant sont : ClO- / Cl- et I2/I-. Ecrire la demi-équation électronique propre au couple I2/I- . I2 + 2e- = 2I-. La demi équation relative au couple ClO- / Cl- en milieu basique s'écrit : ClO- +H2O+ 2e- = Cl-+2HO-. (2) A partir de ces deux demi-équations retrouver l'équation de la réaction entre les ions iodure et les ion hypochlorite : ClO- +2I- +H2O = Cl-+2HO- +I2 2I- = I2 + 2e- (3). (2) + (3) s'écrit : ClO- +H2O+ 2e- + 2I- = I2 + 2e-+ Cl-+2HO-. soit ClO- +2I- +H2O = Cl-+2HO- +I2
Radioactivité. 8 pts L'iode 123 est noté 12353I. Cet isotope est utilisé pour réaliser des explorations fonctionnelles de la thyroïde. Qu'appelle t-on isotope ? Deux isotopes ne se différencient que par leur nombre de neutrons : ils ont le même numéro atomique Z. Que représente le nombre 123 ? Le noyau d'iode 123 compte 123 nucléons ( protons et neutrons) Que représente le nombre 53 ? Le noyau d'iode 123 compte 53 protons ; 53 : nombre de charge. Quelle est la composition du noyau d'iode ? 53 protons et 123-53 = 70 neutrons. Cet isotope est radioactif. Citer deux effets de la radioactivité sur le corps humain. Les particules ionisantes et le rayonnement g sont capables de provoquer des réactions chimiques et des modifications dans la structure des molécules constituant la matière vivante. En particulier, ils peuvent induire des mutations génétiques lorsque l'ADN se trouve modifié. Malaises, vomissements, nausées, diarrhée, anorexie, grande fatigue ; modification de la formule sanguine Comment se protéger des effets nocifs de la radioactivité ? - s’éloigner de la source de rayonnements - mettre un ou plusieurs écrans entre la source de rayonnements et les personnes. ( murs de béton, des parois en plomb). - diminuer au maximum la durée de l’exposition aux rayonnements. La demi-vie ou période radioactive de l'iode 123 est de 13 heures. Définir le terme demi-vie. Durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés . Durée au bout de laquelle l'activité initiale a diminué de moitié. Au bout de combien de temps peut-on considérer que l'échantillon contenant de l'iode 123 est inactif ? Au bout de 13 H, il reste 50 % des noyaux ; à t = 26 H, il reste 25 % des noyaux .... A chaque demi-vie, la moitié des noyaux initiaux disparaît. Au bout de 10 demi-vie soit 13*10 = 130 H ( environ 5 jours) il reste 1/210 = 1/1024 = 0,1 % des noyaux initiaux : on peut considérer la source comme inactive. Un autre isotope utilisé en thérapie est l'iode 131. Lors de la transformation radioactive de l'iode 131, il y a émission d'un électron noté e-. Comment se nomme le rayonnement dû à l'émission d'un électron ? b-. Compléter l'équation ci-dessous : 13153I --> AZX + 0-1e. Conservation de la charge : 53 = Z-1 d'où Z = 54. Conservation du nombre de nucléons : 131 = A. Identifier le noyau fils X en s'aidant des données ci-dessous : 13154Xe 51Sb ; 52Te ; 53 I ; 54 Xe.
|
||||||
|
|
||||||
|
|