|
Taux d'alcoolémie : spectrophotométrie bac S Reunion 2008.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2Cr2O7 2- aq+ 3CH3CH2OHaq + 16H+ aq = 4 Cr 3+aq + 3CH3COOH aq + 11 H2O(l). Cette réaction étant lente, son évolution est suivie par spectrophotométrie. Données : masse molaire de l'éthanol 46 g/mol Couleurs des espèces chimiques en présence :
Expliquer pourquoi cette réaction chimique peut être suivie par spectrophotométrie. L'un des réactif est incolore tandis que l'autre réactif Cr2O7 2- est coloré ; de plus le produit coloré Cr 3+ absorbe à une autre longueur d'onde. Au cours de la réaction la concentration en ion dichromate diminue et en conséquence l'absorbance de la solution. La mesure de l'absorbance ne fait intervenir
aucune réaction chimique au cours de
laquelle une espèce disparaitrait.
On choisit la longueur d'onde pour laquelle l'espèce colorée présente un maximum d'absorption. L'ion dichromate étant jaune orangé, il absorbe la couleur compémentaire du jaune orangé, c'est à dire le bleu : d'où le choix d'une longueur d'onde de l'ordre de 420 nm. Etablir un tableau d'avancement du système en désignant par n0 la quantité de matière initiale d'alcool présente dans 2 mL de sang et par n1 la quantité de matière initiale d'ion dichromate. Dans les conditions de l'expérience, l'ion H+ est en excès.
Quelle relation existe entre l'avancement x, la concentration en ion dichromate [Cr2O7 2- ], le volume V et la quantité de matière n1 ?
A= 150 [Cr2O7 2- ] Montrer que l'absorbance A est reliée à l'avancement x par la relation : x= (10-4A) 10-5 (mol). V = 12 10-3 L ; n1 = 0,01* 2,0 10-2 = 2,0 10-4 mol ; (n1-2x)/V =(2 10-4 / 12 10-3 - 2x / 12 10-3 = 0,1/ 6 -103x/ 6. 150 (n1-2x)/V = 2,5 - 2,5 104x
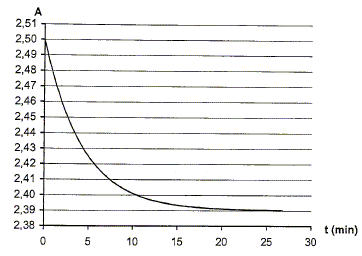
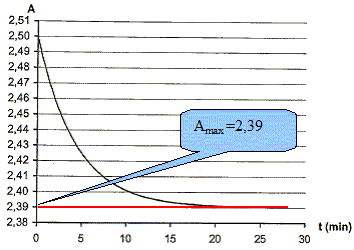
La réaction peut être considérée comme totale. A l'aide du graphique A=f(t), calculer l'avancement maximal. En dédduire que le réactif limitant est l'éthanol.
xmax=(10-4Amax) 10-5mol xmax=(10-4*2,39) 10-5 = 4,4 10-6 mol. Or n1 = 2 10-4 mol : l'ion dichromate est en escès et l'alcool en défaut. Le taux autorisé d'alcool est 0,5 g dans 1 L de sang. Le conducteur est-il en infraction ? Quantité de matière d'alcool : n0-3xmax =0 ; n0 = 3xmax = 3*4,4 10-6 =1,32 10-5 mol dans 2 mL de sang soit : 1,32 10-5 *500 = 6,6 10-3 mol dalcool dans 1 L de sang.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|