|
le bleu de bromothymol, catalyse, estérification bac S Polynésie septembre 2008. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
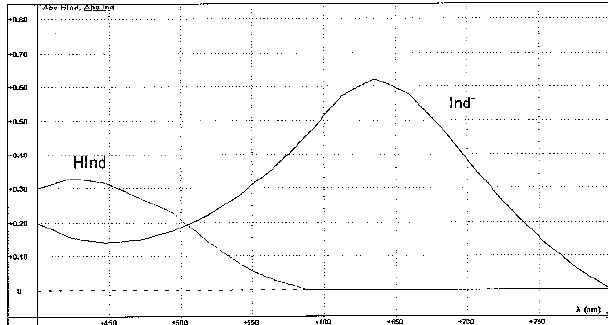
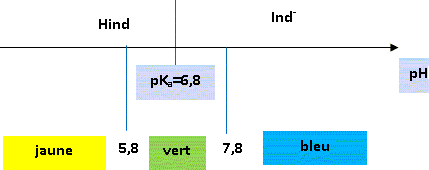
Etude spectrophotométrique : Les courbes ci-dessous représentent l'absorbance de l'espèce HInd et celle de l'espèce Ind - en fonction de la longueur d'onde l .
Justifier la teinte
jaune de la forme
acide. La forme Hind
présente une absorption maximale vers 440
nm. Cette longueur d'onde correspond au
bleu-violet. Une solution contenant la
forme acide Hind est donc jaune, couleur
complémentaire de la couleur bleu-violet
absorbée.
En 1862, Marcellin Berthelot, qui a étudié la réaction d'estérification, écrit dans les annales de chimie et physique " Trois phénomènes* essentiels caractérisent la combinaison d'un acide avec un alcool ". Par ailleurs, on peut lire sur l'Institut Français du Pétrole : " En 2005, Yves Chauvin obtient le prix Nobel de chimie pour l'étude de la réaction de métathèse (changer de place) sur les doubles liaisons carbone-carbone. Grâce au développement de catalyseurs, on produit de nouveaux médicaments, polymères et surtout on économise de nombreuses étapes dans les processus de synthèses organiques. La métathèse s'intègre dans une chimie verte " *phénomènes : caractéristiques. Les activités du chimiste. Citer au moins un " phénomène " sur les trois " phénomènes essentiels " cités par Berthelot. estérification, lente limitée, athermique. Quel nom donne-t-on à la réaction d'un ester et de l'eau ? hydrolyse. Quel est l'intérêt d'un catalyseur ? Un catalyseur augmente la vitesse d'une transformation chimique. Dans certain cas il peut orienter une réaction chimique. Une estérification historique. Marcellin Berthelot a utilisé un mélange équimolaire d'acide acétique (acide éthanoïque) et d'éthanol. Par titrage de l'acide, il a obtenu les résultats suivants à 20°C.
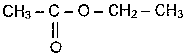
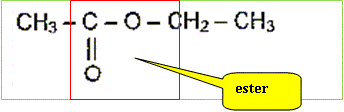
Reproduire sur votre copie la formule semi-développée du produit, entourer le groupe caractéristique et donner le nom de ce groupe.
Écrire l'équation de la réaction d'estérification et sa constante d'équilibre K. CH3-COOH+ CH3-CH2OH = CH3-COO-CH2-CH3 + H2O. K = [CH3-COO-CH2-CH3]éq[H2O]éq/ ( [CH3-COOH]éq[CH3-CH2OH]éq) La quantité initiale d'acide acétique est de 1,00 mol. Dresser le tableau d'avancement du système.
Etat final atteint à la date t=368 jours : xf = 0,55 mol. Calculer le rendement de la transformation. xf/xmax = 0,55/1 = 0,55 ( 55 %). Actuellement on obtient, comme valeur finale, 0,67 mol d'ester. Comment interpréter la différence avec l'expérience historique ? Au bout de 328 jours l'équilibre n'est pas encore atteint. De nos jours, l'emploi de catalyseur et le montage type chauffage à reflux ( travail à température modérée, supérieure à 20 °C) permettent d'atteindre , en quelques heures, l'équilibre.
La métathèse par Chauvin. Dans le texte, on cite les doubles liaisons carbone-carbone. Quel est le nom de la famille qui contient de telles liaisons ? Alcènes. La catalyse utilisée peut être homogène ou hétérogène. Expliquer les deux termes homogène et hétérogène.
Quel est l'intérêt de cette élimination ? En éliminant l'un des produits au fur et à mesure de sa formation, on déplace l'équilibre dans le sens direct, formation de l'ester ; le rendement augmente et peut atteindre 100 %. Proposer un facteur cinétique qui peut augmenter la vitesse de réaction de métathèse. La température est un facteur cinétique favorable.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|