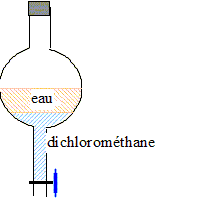|
Le sirop de menthe : chromatographie, extraction, spectrophotométrie bac S France septembre 2008. |
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
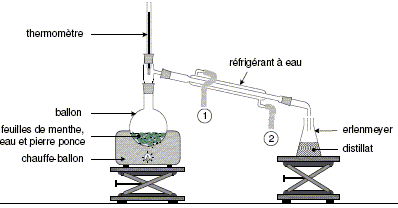
Sucre, eau, sirop de glucose-fructose,arôme naturel de menthe, colorants : E102- E131. L’objectif de cet exercice est d’étudier une méthode d’extraction d’un arôme naturel de menthe puis d’analyser les colorants contenus de ce sirop. Les parties 1 et 2 sont indépendantes. Extraction de l’arôme naturel de menthe. L’arôme naturel de menthe est principalement
dû à deux molécules : le menthol et la
menthone que l’on trouve dans l’huile essentielle
de menthe. Cette dernière est extraite à
partir des feuilles de menthe. On donne quelques
caractéristiques physiques
On ne peut pas réaliser directement la chromatographie du sirop de menthe à cause de la présence des sucres. On procède alors en deux étapes. Étape 1 : extraction des colorants. Des brins de laine écrue (c'est-à-dire non teintée) sont trempés dans une solution d’ammoniac pendant quelques minutes puis ils sont rincés et séchés. Ils sont ensuite placés dans un bécher contenant du sirop de menthe. Les colorants contenus dans le sirop se fixent, à chaud et en présence d’acide éthanoïque, sur les brins de laine. Après rinçage et essorage, les brins de laine teints en vert sont placés dans une solution d’ammoniac où ils se décolorent. La solution verte obtenue est portée à ébullition afin de la concentrer par évaporation d’eau. Cette solution est ensuite analysée par chromatographie.
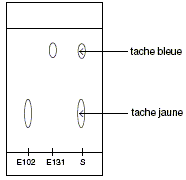
Non
, les colorants alimentaires utilisés comme
étalons ( référence) et la
solution S sont colorés respectivement en
jaune, bleu et vert. Indications de l'étiquette " arôme naturel de menthe, colorants : E102- E131". On identifie dans la solution verte le colorant E102 ( deux taches jaunes ayant le même rapport frontal. On identifie dans la solution verte le colorant E131 ( deux taches bleues ayant le même rapport frontal. À partir des données, proposer une interprétation de la disposition relative des taches sur le chromatogramme. Le colorant jaune E102 est peu soluble dans l'éluant, solution de chlorure de sodium : ce colorant présentant peu d'affinité pour cet éluant est peu entraîné par la phase mobile et migre peu. En revanche, le colorant bleu E131 est très soluble dans l'éluant : ce colorant présentant une grande d'affinité pour cet éluant est beaucoup entraîné par la phase mobile et migre plus haut que l'autre colorant..
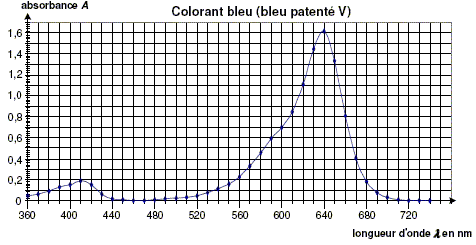
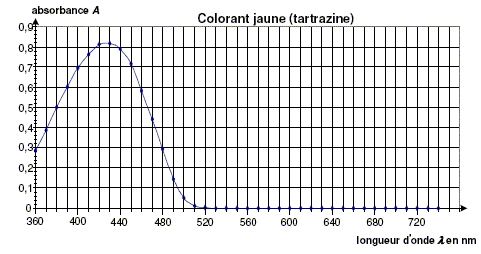
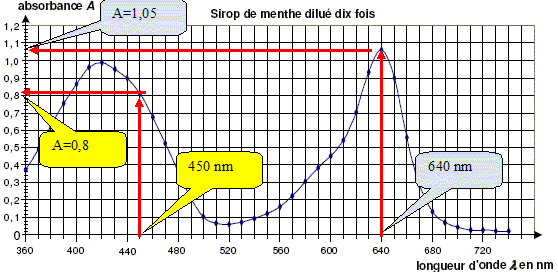
Détermination de la concentration de chaque colorant dans le sirop par spectrophotométrie. Pour déterminer la concentration en colorant jaune et en colorant bleu dans le sirop, on réalise les expériences suivantes à partir du sirop de menthe dilué dix fois, d’une solution de tartrazine à 2,00 × 10-2 g/L et d’une solution de bleu patenté V à 1,00 × 1010-2 g/L. A l’aide d’un spectrophotomètre, on obtient les courbes donnant l’absorbance A en fonction de la longueur d’onde l pour les trois solutions. Les courbes obtenues pour les colorants sont représentées ci-dessous :
Pourquoi choisit-on de se placer à la longueur d’ondel = 450 nm plutôt que 420 nm pour réaliser le dosage par étalonnage de la tartrazine dans le mélange ?
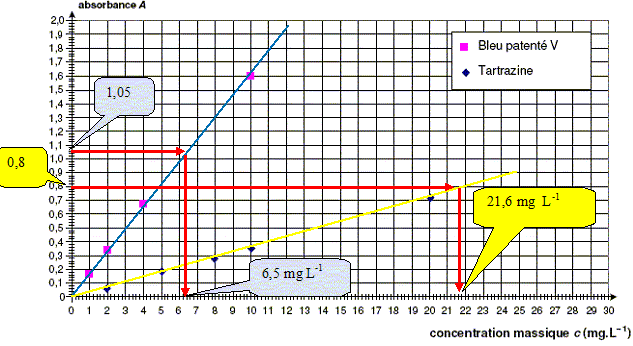
On réalise ensuite une échelle de teintes à partir des solutions de colorants. On mesure l’absorbance de chaque solution à l’aide du spectrophotomètre en se plaçant à la longueur d’onde l 1 = 450 nm pour la tartrazine et à la longueur d’onde l 2 = 640 nm pour le bleu patenté V. On obtient les graphiques A = f(c) pour chaque colorant alimentaire, c étant exprimée en mg / L. A partir des figures, déterminer graphiquement la concentration massique en colorants jaune et bleu dans le sirop dilué. On fera apparaître clairement les constructions sur les figures. En déduire les concentrations massiques en colorant tartrazine cmT et en colorant bleu patenté cmB dans le sirop. Multiplier les valeurs lues sur le graphe par 10 pour tenir compte de la dilution. cmT =2,2
102 mg
L-1
;
cmB =65
mg L-1
|
|||||||||||||||||||||||||||||||||||||||||||
|
|