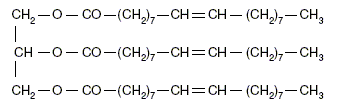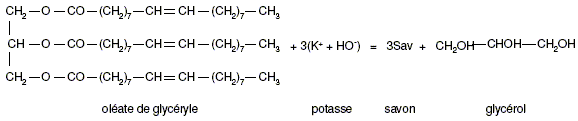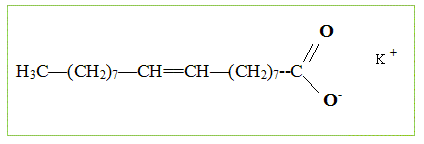|
Histoire de savons : bac S France septembre 2008. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
Le savon tire son nom du premier centre de fabrication : Savona, port ligure ouvert sur le golfe de Gênes. En 1779, William Scheele identifie le glycérol, alors qu’il saponifiait divers corps gras. À partir de 1809, Eugène Chevreul entreprend une étude approfondie des corps gras ; il identifie les principales matières grasses et interprète la saponification comme une réaction chimique. La formule brute du glycérol est établie en 1836 par Jules Pelouze ; en 1859, Adolphe Wurtz découvre « la série des glycols » (diols) et en 1873, Charles Friedel fait la synthèse du glycérol. La révolution industrielle développe les besoins en savon, qui cesse d’être un produit de luxe et devient un produit de première nécessité. D’après un site Internet (1) Le texte utilise l’expression « lessive de cendres et de chaux » pour nommer une solution aqueuse contenant de l’ hydroxyde de potassium et de calcium L’objectif de l’ exercice est
d’étudier différentes étapes de la
fabrication d’un savon au laboratoire et quelques
propriétés des savons.
Les parties 1, 2 et 3 de cet exercice sont
indépendantes. Fabrication du savon. Le principal constituant de la graisse de boeuf est l’oléate de glycéryle (ou oléine). On réalise la saponification par une solution d’hydroxyde de potassium (K + + HO- ) d’une huile que l’on considèrera comme constituée exclusivement d’oléine, de formule semi-développée :
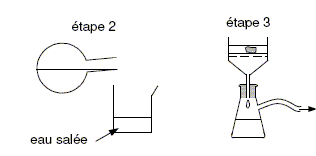
Après la synthèse, on réalise les deux étapes suivantes décrites sur la figure ci-dessous :
Justifier, à l’aide du tableau des données, l’utilisation d’eau salée dans l’étape 2. Le savon est peu soluble dans l'eau salée : il va donc précipiter sous forme d'un solide. Filtration
sous vide : Le savon est récupéré plus
rapidement ; le savon est plus sec que dans le cas
d'une filtration simple. De plus les
impuretés solubles dans le solvant sont
éliminées dans le filtrat
(liquide). Écrire une formule semi-développée du savon noté Sav dans l’équation.
Sachant que l’hydroxyde de potassium a été introduit en excès, calculer la quantité de matière maximale de savon nSav que l’on peut obtenir lors de la saponification de 884 kg de cette huile végétale. Quantité de matière d'huile : n (mol) = m(g) / M g/mol) =884 103 / 884 = 1,00 103 mol. D'après les coefficients stoechiométriques : nSav = 3 nhuile = 3,00 103 mol. Montrer que la masse maximale de savon mSav susceptible d’être obtenue est 960 kg. mSav = nSav MSav =3,00 103*320= 960 103 g = 960 kg. Quelle est la masse de savon réellement obtenue mr si le rendement de l’expérience est égal à 90% ? Aide aux calculs : 9,6/9 = 3,1 ; 9,6*0,9 ~ 8,6 ; 90/9,6~9,4 960*0,9 = 9,6*0,9*100 ~ 8,6*100~ 860 kg.
Questions relatives à l'histoire des savons. Le texte utilise les termes « savons » et « graisses de mouton, de boeuf ou de chèvre ». Attribuer à chacun de ces deux termes la famille chimique correspondante choisie parmi les trois suivantes : triester d’acides gras, acide carboxylique, carboxylate de potassium. "savons" : carboxylate de potassium " graisses de mouton, de boeuf ou de chèvre" : triester d'acide gras. Quel facteur cinétique a permis d’améliorer la recette de Galien au XVème siècle ? "La fabrication du savon, par ébullition d’un corps gras et d’une base, ne se développera qu’au XVème siècle" Le facteur cinétique est la température. Le glycol est le plus simple des diols. On donne sa formule semi-développée : CH2OH – CH2OH Recopier cette formule, entourer le (ou les) groupe(s) caractéristique(s) et nommer la fonction correspondante. Deux fonctions alcools primaires – CH2OH sont présentes.
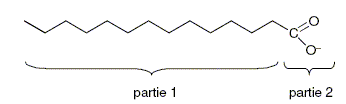
Un ion carboxylate peut-être schématisé par :
Identifier la partie hydrophile et la partie hydrophobe de l’ion. La partie 1, longue chaine carbonée est hydrophobe ; la partie 2, portant une charge électrique, est hydrophile ( amie de l'eau) Que représente la partie 1 de l’ion carboxylate ? CH3-(CH2)7-CH=CH-(CH2)7-.
|
||||||||||||||||||||||||||||
|
|