|
Solubilité de l'acide benzoïque bac S Nlle Calédonie 03/2008. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
L'acide benzoïque et ses sels (benzoate de sodium ou de potassium) sont efficaces contre les levures et à un moindre degré, contre les moisissures. Ils sont peu actifs contre les bactéries mais agissent tout de même sur les bactéries lactiques. La solubilité d'une espèce chimique représente, à une température donnée, la quantité de matière maximale de cette espèce que l'on peut dissoudre par litre de solution. Il s'agit ici d'étudier l'évolution de la solubilité de l'acide benzoïque C6H5CO2H(s) dans l'eau en fonction de la température. La solubilité de l'acide benzoïque dans l'eau augmente quand la température augmente. Cette propriété est utilisée dans un procédé de purification des produits : la recristallisation. Données : Masse molaire moléculaire de l'acide benzoïque M = 122 g/mol . Conversion de degré celsius en kelvin : T(K) = q(°C) + 273. Composition d'une solution saturée d'acide benzoïque. L'acide benzoïque se présente à l'état pur sous la forme de cristaux blancs. La dissolution de l'acide benzoïque dans l'eau se traduit par l'équation suivante : C6H5CO2H(s) = C6H5CO2H (aq) Une solution saturée est obtenue lorsque l'acide benzoïque solide reste présent dans la solution. A24°C, on peut dissoudre au maximum 3,26 g d'acide benzoïque par litre de solution. Écrire
l'équation de la réaction entre
l'acide benzoïque et l'eau. C6H5CO2H (aq)
+ H2O(l)
=C6H5CO2-
(aq) +
H3O+(aq).
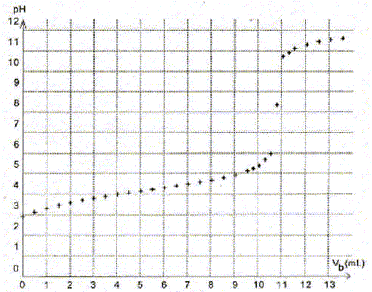
Plusieurs solutions saturées d'acide benzoïque sont préparées selon le protocole suivant : - A une masse de 0,55 g d'acide benzoïque placée dans un erlenmeyer, ajouter 100 mL d'eau distillée. - Chauffer au bain-marie afin de dissoudre l'acide benzoïque. - Refroidir sous courant d'eau froide jusqu'à une température supérieure de 5°C à la température q souhaitée. - Verser le contenu de l'erlenmeyer dans un bécher thermostaté à la température q. Attendre que la température se stabilise. - Prélever un volume Vp = 20,0 mL de solution surnageante. Placer cette solution dans un bécher thermostaté. Différentes solutions saturées d'acide benzoïque sont ainsi obtenues à différentes températures q allant de 24°C à 50°C. Chacune des solutions est titrée par une solution d'hydroxyde de sodium de concentration cb= 5,0 10-2 mol/L ; le volume titré est Vp = 20,0 mL. On s'intéresse ici au titrage de la solution obtenue à 24°C. La courbe obtenue lors de ce titrage donnant l'évolution du pH en fonction du volume Vb d'hydroxyde de sodium versé est représentée :
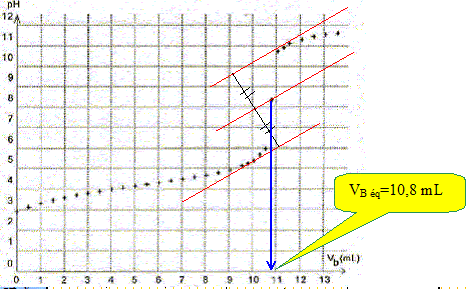
Écrire l'équation de la réaction modélisant la transformation ayant lieu lors du titrage de l'acide benzoïque. Couples acide / base : C6H5CO2H (aq) /C6H5CO2- (aq) et H2O(l) / HO- (aq). C6H5CO2H (aq) + HO- (aq) = C6H5CO2- (aq) +H2O(l). Définir l'équivalence du titrage. A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence, l'acide benzoïque est en excès ; après l'équivalence la soude est en excès Déterminer par une méthode graphique que l'on fera apparaître sur la figure le volume Vb éq de solution d'hydroxyde de sodium versé à l'équivalence.
Calculer la concentration molaire c d'acide benzoïque dissous dans la solution. En déduire la valeur de la solubilité de l'acide benzoïque à 24°C. A l'équivalence VB éq CB = C VP d'où C = VB éq CB / VP . C=10,8*5,0 10-2 / 20,0 =2,70 10-2 mol/L. s = 2,70 10-2 mol/L. En déduire la masse maximale d'acide benzoïque que l'on peut dissoudre dans 100 mL de solution à 24°C. titre massique (g/L) = masse molaire (g/mol) * concentration molaire ( mol/L) t = 122*2,7 10-2 =3,29 g/L ; soit 0,329 g introduits dans 100 mL. Comparer cette masse à celle introduite initialement et expliquer alors l'expression " solution saturée " employée. "A une masse de 0,55 g d'acide benzoïque placée dans un erlenmeyer, ajouter 100 mL d'eau distillée". La masse de solide dissout 0,33 g est inférieure à la masse de solide introduite 0,55 g. Il reste du solide au fond du récipient. "Une solution saturée est obtenue lorsque l'acide benzoïque solide reste présent dans la solution".
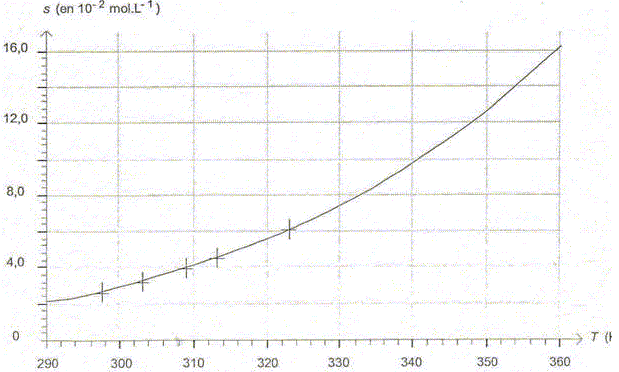
Variation de la solubilité de l'acide benzoïque dans l'eau en fonction de la température.
Les valeurs des solubilités des différentes solutions ont été mesurées suivant la même méthode, puis traitées par un tableur grapheur. La figure ci-dessous représente l'évolution de la solubilité s en fonction de la température T exprimée en kelvin.
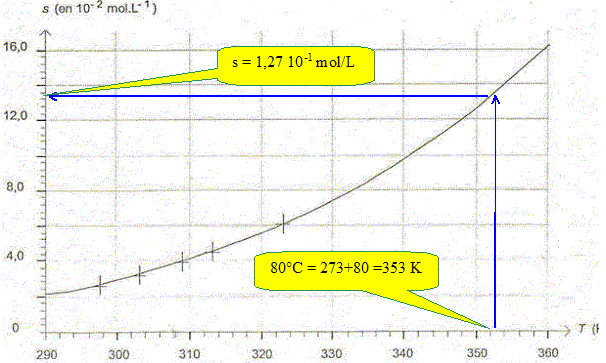
Parmi les quatre équations proposées ci-dessous, une seule peut modéliser la courbe de la figure. Choisir l'expression correcte. Justifier. (1) s = a T + b ; (2) s = b exp(-a.T) ; (3) s = b exp (-a/ T) ; (4) s =a/T +b ; a et b étant des constantes positives. (1) est exclu, c'est l'équation d'une droite. (2) est exclu, il s'agit d'une exponentielle décroissante. (4) est exclu, il s'agit d'une branche d'hyperbole décroissante. Seule l'expression (4) correspond à une fonction croissante. En effet quand T croït, 1/T diminue, exp(-a/T) augmente et la solubilité augmente. A l'aide de la figure, déterminer la valeur de la solubilité de l'acide benzoïque s à une température de 80°C.
|
||||||||||||||||||||||||||||
|
|