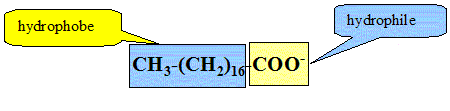|
Le savon à l'ancienne bac S Asie 2008.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Les alcalis. " A partir des cendres de plantes marines, on obtenait l'alcali minéral....Avec partir des cendres de plantes terrestres, on obtenait l'alcali végétal..." D'une manière générale les alcalis sont des bases. Donner la définition d'une base selon Bronsted. Espèces, ion ou molécules, susceptibles de gagner un proton H+. L'alcali minéral est la soude ou hydroxyde de sodium NaOH ; l'alcali végétal est la potasse ou hydroxyde de potassium KOH. Dans ces deux alcalis, quel est l'ion leur confère leur propriété de base dans l'eau ? ion hydroxyde HO-aq. Quel est l'acide conjugué de cet ion ? H2O(l). " Connu et utilisé avant l'ère
chrétienne, le savon était, à
l'origine, une mixture obtenue par mélange
de suif et de cendres." Quel était le
corps gras utilisé à l'origine dans
la fabrication du savon ? le
suif.
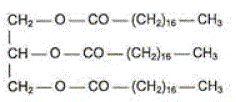
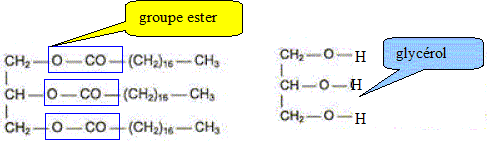
Lorsqu'on fait réagir une solution de soude concentrée sur le triester ci-dessus, on obtient une mixture désignée sous le nom de savon. Comment s'appelle cette réaction ? Saponification, ou hydrolyse basique. Que savez vous de l'avncement final d'une telle hydrolyse ? xmax = xfin : le taux d'avncement final vaut t=1. Le savon obtenu est l'octadécanoate de sodium. L'ion octadécanoate est la base conjuguée de l'acide octadécanoïque. Quelle est la formule semi-développée de cet ion ? CH3-(CH2)16-COO-. Identifier sur la formule de cet ion la partie hydrophile et la partie hydrophobe.
Préparation du savon au laboratoire. Dans un ballon on introduit 20,0 g du triester et un volume V=40,0 mL de solution d'hydroxyde de sodium de concentration molaire en soluté apporté c= 10,0 mol/L. On y ajoute quelques grains de pièrre ponce et on chauffe à reflux. Pourquoi chauffer ? Pourquoi à reflux ? En chauffant on accélère la réaction. Le reflux évite toute perte de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le milieu réactionnel. L'équation simplifiée de la réaction peut s'écrire : 1 triester + 3 (Na+aq + HO-aq) = 3 [CH3-(CH2)16-COO-aq + Na+aq] + 1 glycérol. Calculer les quantités de matière initiale des réactifs. M(triester)=884 g/mol ; M(dodécanoate de sodium)=304 g/mol
Si la soude est en défaut : 0,4-3xmax =0 ; xmax =0,4/3 =0,133 mol. On retient la plus petite valeur : xmax =2,26 10-2 mol , le triester est le réactif limitant. En déduire la masse de savon attendue.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|