|
Identifier un acide carboxylique bac S Antilles 09/08. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
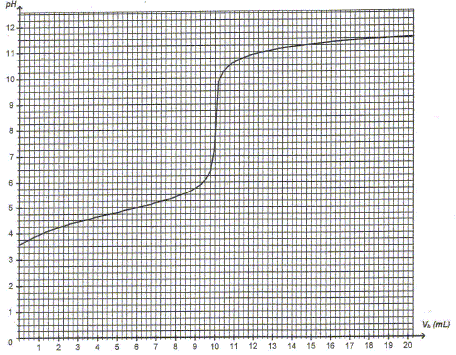
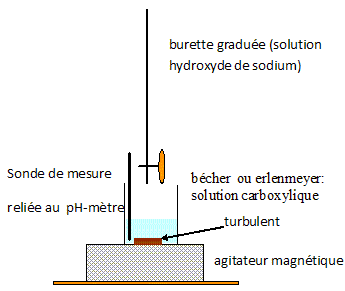
Titrage de l'acide carboxylique. On titre un volume Va= 50,0 mL d'acide carboxylique de concentration molaire C par une solution aqueuse Sb d'hydroxyde de sodium ( Na+ (aq) + HO- (aq)) de concentration molaire Cb= 2,5 10-2 mol/L. On note Vb le volume de solution d'hydroxyde de sodium versé. Le suivi pH-métrique du titrage donne la courbe suivante.
Ecrire l'équation de la réaction
du titrage. Les couples acide / base sont : R-COOH (aq) / R-COO-(aq)
et H2O / HO-(aq). R-COOH (aq) + HO-(aq)
=R-COO-(aq) + H2O. Etablir le tableau d'avancement
en utilisant les grandeurs C, Va, Cb
et Vb.
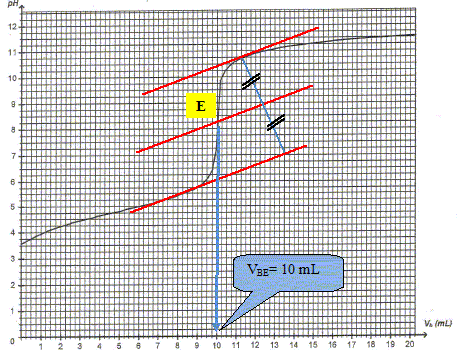
A l'équivalence les quantités
de matière des réactifs mis en présence
sont en proportions stoechiomètriques. Avant l'équivalence
l'acide carboxylique est en excès ; après l'équivalence
l'hydroxyde de sodium est en excès. iner graphiquement le volume VBE à l'équivalence et en déduire la valeur de la concentration molaire C de l'acide. A l'équivalence C Va = CbVb.
RCOOH (l) + H2O(l)
= RCOO-(aq) +
H3O+(aq). Donner l'expression de
la constante d'acidité Ka du couple
RCOOH(aq) / RCOO-(aq).
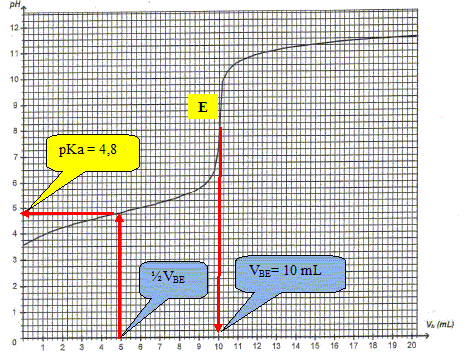
Avant l'équivalence l'hydroxyde de sodium est en défaut et constitue le réactif limitant. En utilisant le tableau d'avancement montrer que pour Vb = ½VBE on a xf = ½CbVBE .
Montrer que pour Vb = ½VBE on a [RCOOH (aq)]½éq = [ RCOO-(aq)]½éq. A l'équivalence :
C Va =
CbVBE soit
CVa-xf =
CbVBE -xf
=CbVBE
-xf = CbVBE
-½CbVBE
=½
CbVBE xf
=½
CbVBE Déduire l'expression du pH pour Vb = ½VBE.
On identifie l'acide éthanoïque H3C-COOH.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|