|
enseignement, concours, caplp interne 2006 : pile et oxydoréduction |
|||
|
|||
|
red = Ox + n e-. par exemple : Al = Al3+ + 3e-. oxydation de l'aluminium Un oxydant est une espèce susceptible de capter un ou plusieurs électron(s). MnO4- + 8H+ + 5e- = Mn2+ + 4H2O réduction de l'ion permanganate Un couple oxydant réducteur
noté ox / red est l'ensemble d'un réducteur et
d'un oxydant tels que :
red = ox + n e-
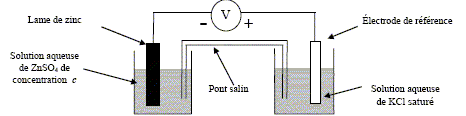
On s’intéresse au système constitué par une lame de zinc Zn plongé dans une solution aqueuse de sulfate de zinc ZnSO4 de concentration c en mol.L-1. Pour déterminer le potentiel pris par la lame de zinc, on réalise le montage ci-dessous :
Demi-équation redox correspondant au couple oxydant/réducteur du zinc : Zn = Zn2+ + 2e-. Rôle du pont salin ( papier imprègné KCl): assure la continuité électrique ; permet aux solutions de rester électriquement neutre. Une électrode de référence garde un potentiel électrique constant, pour une température donnée.
Demi équation redox correspondant à cette demi pile : Hg2Cl2 (s) + 2e- = 2Hg(liquide) + 2Cl-. Dans cette électrode, on utilise une solution aqueuse de KCl saturée afin que [Cl-]= constante.
La valeur du potentiel de l’électrode au calomel, dans les conditions de l’expérience, est E0 = 0,245 V. Valeur EZn du potentiel redox du couple du zinc dans les conditions de l’expérience e = E0 -EZn soit EZn =E0 -e = 0,245-1,185 = -0,94 V Or EZn =E°(Zn2+/Zn )+ 0,06/2 ln[Zn2+] avec E°(Zn2+/Zn ) = -0,76 V d'où la concentration c de la solution aqueuse de sulfate de zinc : ln[Zn2+] =(-0,94+0,76)/0,03 = -6 ; c =
[Zn2+] =1,0
10-6 mol/L.
Quantité d’électricité Q échangée : Q=It= 0,2*6*3600 = 4320 C Nombre de moles d’électrons qui ont quitté la plaque de zinc : 4320/96500 = 0,0447 ( 0,045 mol) n(Zn) = ½n(électrons) soit : 0,0224 mol de zinc Perte de masse de cette plaque : m= n M zinc = 0,0224*65,4 = 1,5 g. La solution aqueuse de sulfate de zinc a un volume V = 0,5 L. Quantité de matière d'ion zinc formé : 0,0224 mol d'où :[Zn2+]=0,0224/0,5 = 0,045 mol/L Valeur de la f. e. m. de la pile après les 6 heures de fonctionnement : EZn =E°(Zn2+/Zn )+ 0,06/2 ln[Zn2+] = -0,76 + 0,03 log 0,045 = -0,80 V e = E0 -EZn = 0,245-(-0,80)=1,04 V. |
|||
|
|
|||
|
|