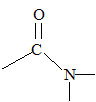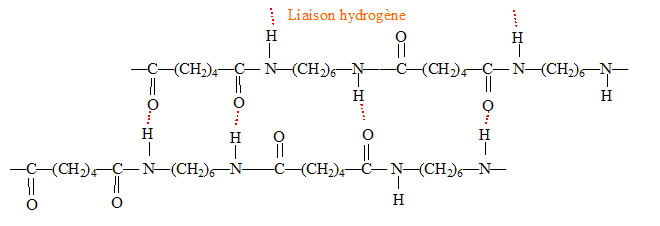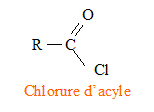|
enseignement, concours, caplp interne 2006 : à propos des matières plastiques |
|||||||||
|
|||||||||
|
Thermoplastiques : fondent de manière réversible en les chauffant. Polyéthylène (PE) ; Polypropylène (PP) ; Polychlorure de vinyle (PVC) ; Polystyrène (PS). Thermodurcissables : durcissent de façon irréversible, permanente en les chauffant. Triacétate de cellulose (films) ; résines phénoliques ; résine urée et mélamine-formaldéhyde ; résines époxydes ; Un premier classement des matières plastiques peut être fait par un test de combustion ; on les classe alors en « auto-extinguibles » ou « non auto-extinguibles ». Auto-extinguibles : la combustion ne se propage pas si on enflamme le matériau plastique [ PVC ; Polytétrafluoroéthylène (PTFE)] Non auto-extinguibles : ( combustibles ou inflammables) La combustion se propage si on enflamme le matériau plastique (PE ; PP ; PS ; Polyoxyméthylènes ) Pour repérer ce caractère, on définit l’ « Indice de Dioxygène Limite » (IOL) par : IOL =[O2] / ([O2]+[N2]). Dans l’air, la valeur de l’IOL qui détermine la limite entre « auto-extinguible » et « non auto- extinguible » vaut : 21 % de dioxygène en volume ;d'où IOL =0,21. Une combustion nécessitant peu de dioxygène ( IOL<0,21 ), se propagera : le plastique sera classé "non auto-extinguibles " Une combustion nécessitant beaucoup de dioxygène ( IOL>0,21 ), ne se propagera pas, sans apport d'air extérieur : le plastique sera classé " auto-extinguibles "
Afin de déterminer l’appartenance à une famille, on dispose d’autres tests :
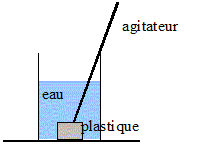
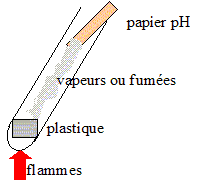
On dispose de quatre échantillons de matières plastiques supposés appartenir à des familles différentes : - l’échantillon A est supposé être un polystyrène (PS) : il réagit, se ramollit en présence d'acétone. - l’échantillon B est supposé appartenir à la famille des polyamides (PA) : le test au papier pH indique des fumées basiques, pH>7. - l’échantillon C est supposé être un polychlorure de vinyle (PVC) : c'est un produit chloré, le test de Belstein est positif. - l’échantillon D est supposé être une polyoléfine (matériaux résultant de la polymérisation de monomères hydrocarbonés insaturés, de densité comprise entre 0,91 et 0,96). exemple : polyéthylène --[CH2--CH2]n-- ; le monomère et l'éthylène CH2=CH2. Le test de densité est positif ( le matériau va flotter)
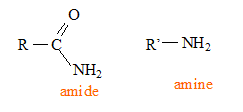
La fonction amide se
caractérise par la présence du groupement
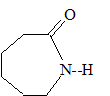
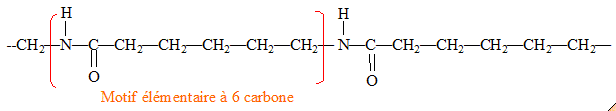
fonctionnel : Les différents polymères de cette famille peuvent être obtenus soit par polyaddition, soit par polycondensation. polyaddition : addition de plusieurs centaines de molécules identiques les unes aux autres. polycondensation : réaction chimique entre deux molécules différentes ; on observe l'élimination d'eau ou de chlorure d'hydrogène. Le PA 6, encore appelé nylon 6, s’obtient par polyaddition d’un monomère, le caprolactame C6H11NO.
Représentation d'un fragment de structure de la macromolécule obtenue par polyaddition en identifiant le motif élémentaire de la chaîne :
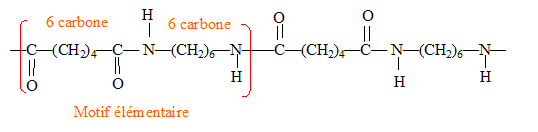
HOOC-(CH2)4-COOH et d’une diamine de formule H2N-(CH2)6-NH2. ( avec élimination de H2O) Représentation d'un fragment de structure du nylon 6-6 en identifiant le motif élémentaire de la chaîne :
Les polyamides ont des points de fusion élevés et de bonnes propriétés mécaniques : présence de liaison hydrogène entre les chaînes.
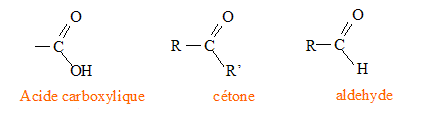
De nombreux autres composés contiennent dans leur molécule le groupement carbonyle, tels que les acides carboxyliques, les cétones ou les aldéhydes.
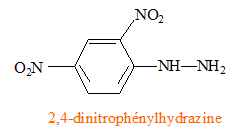
R et R' sont des chaînes carbonnées. La DNPH, dont le nom est 2,4-dinitrophénylhydrazyne, permet de mettre en évidence la présence d’une cétone ou d’un aldéhyde. Il se forme un précipité jaune. Représentation de la formule
semi développée de la molécule de DNPH
: Comment différencier un aldéhyde d’une cétone ? Un aldehyde est un réducteur
( pas la cétone) : un aldehyde réagit avec le
nitrate d'argent ammoniacal, ( réactif de Tollens) et
avec la liqueur de Fehling.
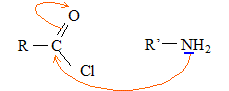
Le mécanisme de la réaction débute par l’attaque du centre nucléophile de l’une des molécules sur le centre électrophyle de l’autre. Le carbone fonctionnel du chlorure d'acyle est déficitaire en électrons ( du fait du caractère électronégatif des atomes de chlore et d'oxygène) : ce carbone constitue un site électrophile. L'atome d'azote de l'amine porte un doublet libre et constitue un site nucléophile.
|
|||||||||
|
|
|||||||||
|
|