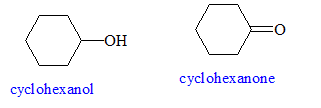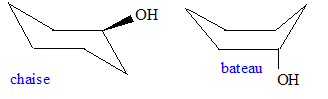|
enseignement, concours caplp externe 2006 : acide hypochloreux : agent oxydant en chimie organique |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
• Préparer 120 mL d’une solution d’ions hypochlorite à partir de 50,0 mL d’eau de Javel de concentration égale à C2 = 2,11 mol.L-1et 70,0 mL d’eau. • Introduire dans un erlenmeyer 10,0 g de cyclohexanol puis 5,0 mL d’acide éthanoïque pur. Ajouter sous agitation magnétique et goutte à goutte les 120 mL de la solution d’hypochlorite de sodium préparée précédemment. On veillera à ce que la température ne dépasse pas 40°C. • Laisser le mélange sous agitation pendant 10 minutes pour assurer une réaction totale. Vérifier que le test au papier Kl/amidon est positif (coloration) On vérifie ainsi l'excès de ClO- ; ce dernier oxyde l'ion iodure en diiode. • Ajouter quelques gouttes d’une solution saturée d’hydrogénosulfite de sodium NaHSO3 puis vérifier que le test au papier Kl/amidon est négatif (absence de coloration). On vérifie ainsi l'absence de ClO- ; ce dernier a été réduit en ion chlorure par HSO3-. Ajouter une quantité suffisante de carbonate de sodium afin d'éliminer l'acide éthanoïque ( réaction acide base) : on observe un dégagement de CO2. • On réalise l’hydrodistillation du mélange jusqu’à obtenir 50 mL de distillat constitué de deux phases. • La phase essentiellement constituée de cyclohexanone est extraite deux fois avec 10 mL d’éther diéthylique. La phase organique est séchée, puis le solvant est éliminé par évaporateur rotatif. La cyclohexanone est finalement purifiée par distillation. On obtient 6,8 g de cyclohexanone. Identification des réactifs : Sur la paillasse de travail se trouvent trois flacons notés A, B, C dans lesquels se trouvent l’éthanol, la cyclohexanone et le cyclohexanol. L’opérateur réalise des tests et reporte les résultats dans le tableau ci-dessous.
Le cyclohexanol, du fait de la symétrie de la molécule, ne possède pas d'énantiomères. Le cyclohexanol n'est pas plan. Les deux formes conformères majoritaires en solution à 25° C sont dessinées ci-dessous : la forme chaise est la plus stable.
Un oxydant autre que l’acide hypochloreux HClO et
les ions permanganate capable d’oxyder le cyclohexanol
en cyclohexanone : l'ion dichromate
Cr2O72- en milieu
acide.
|
|||||||||||||||||||||
|
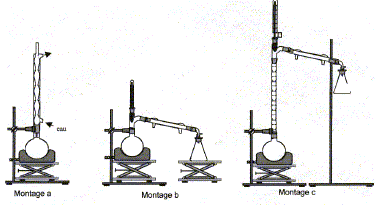
Les deux couples rédox mis en jeu dans la réaction d’oxydation du cyclohexanol en cyclohexanone sont ClO- / Cl- et C6H10O / C6H12O. Demi équations rédox relatives à ces deux couples : ClO- +2e- + 2H+= Cl- + H2O. C6H12O = C6H10O + 2e- + 2H+ Equation qui modélise la réaction d’oxydation : ClO- +C6H12O = C6H10O+ H2O + Cl- Quantité de matière de cyclohexanol introduite : n1 = m/M = 10,0 / 100 = 0,100 mol Quantité de matière d’ions hypochlorite introduite : n2 =2,11*0,05 = 0,105 mol à partir de 0,100 mol de cyclohexanol il faut 0,100 mol d'ion hypochlorite ; or on en a 0,105 mol : ce dernier est en excès et le cyclohexanol est en défaut. Rendement de cette transformation : Qté de matière théorique de cyclohexanone : 0,100 mol masse théorique de cyclohexanone : 0,100* (6*12 + 10+16) = 9,8 g rendement = masse réelle / masse théorique * 100 = 6,8/9,8*100 = 69,4 %. On propose ci-dessous trois montages pour réaliser l’hydrodistillation : il faut utiliser le montage b.
|
|||||||||||||||||||||
|
|