|
enseignement, concours, caplp externe 2006 : cinétique du vieillissement d'une eau de Javel |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
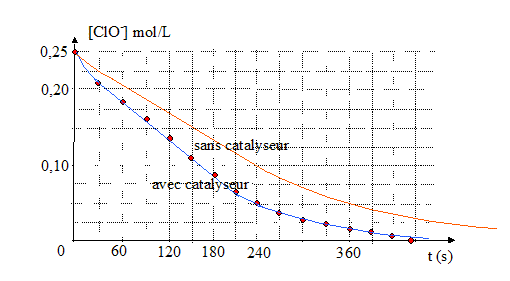
L’eau de Javel se décompose lentement selon la réaction d’oxydoréduction suivante : ClO- = Cl- +½O2 On utilise de l’eau de Javel achetée en berlingot de degré chlorométrique 48°. On dilue la solution commerciale afin d’obtenir une solution S1 cinq fois moins concentrée. Pour étudier la cinétique de cette réaction de décomposition catalysée par les ions Co2+, on utilise un volume V1 = 100 mL de la solution S1. On déclenche le chronomètre à l’instant où l’on met le catalyseur dans la solution. Pour suivre l’évolution de la réaction, on mesure à température et pression constantes le volume de dioxygène dégagé au cours du temps. Dans le tableau suivant, le volume de dioxygène dégagé VO2 est déterminé à la température de 20°C et sous la pression de 1013 hPa.
ClO- = Cl- +½O2 d'après les coefficients stoechiométriques : n(ClO-) disparu = 2n(O2) or n(O2) = PVO2 / (RT) d'où n(ClO-)disparu = 2PVO2 / (RT) n(ClO-)restant = n(ClO-)initial - n(ClO-)disparu et [ClO-] = [ClO-]initial- 2PVO2 / (RTV1) A.N : n(ClO-)fin = n(ClO-)initial - n(ClO-)disparu = 0 d'où n(ClO-)initial = n(ClO-)disparu =2PVO2 fin / (RTV1) P= 1,013 105 Pa ; T= 293 K ; V1=0,1 L ; 2P / (RTV1)=2* 1,013 105 / (8,32*293*0,1) = 831,1 [ClO-] =831,1
10-6( 295-VO2)
avecVO2 en
mL
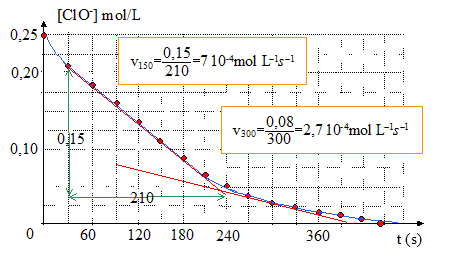
Vieillissement de l’eau de Javel. Le degré chlorométrique français correspond au volume de dichlore gazeux en L, mesuré à 0° C et sous105 Pa nécessaire à la préparation d’un litre d’eau de Javel suivant une transformation totale modélisée par l’équation suivante : Cl2 + 2 Na+aq + 2 HO-aq= 2 Na+aq + Cl-aq+ ClO-aq Calcul du degré chlorométrique de l’eau de Javel utilisée pour l’expérience, en remarquant qu’au bout de 450 s, tous les ions hypochlorites ont été consommés. n(Cl2) = n(ClO-) = 2PVO2 fin / (RTV1) =831,1 10-6 * 295 = 0,245 mol en tenant compte du facteur de dilution : 0,245*5 = 1,23 mol soit 1,23*22,4 = 27,5 °, valeur inférieure à l'indication du fabriquant. Le berlingot d'eau de Javel n'a pas été fabriqué récemment. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|