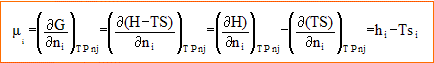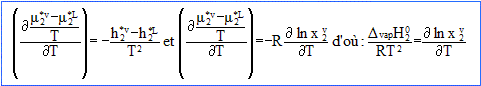|
enseignement, chimie, concours agrégation interne 2006 : diagramme binaire isobare eau cyclohexane. |
|||
|
|||
|
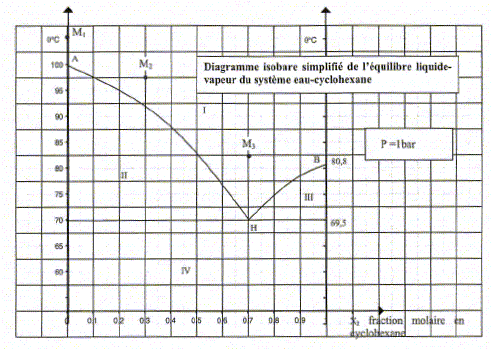
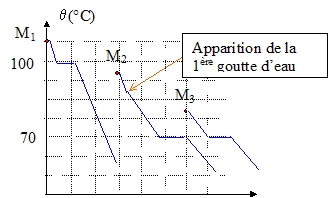
La courbe constituée des branches AH et HB est la "courbe de rosée ": c'est la courbe qui sépare la vapeur du mélange liquide-vapeur. La rosée est le moment où apparaît la première goutte d'eau. Le point H est appelé " hétéroazéotrope". (c’est à dire un mélange "intime" eau-cyclohexane qui a une température d’ébullition différente de 100°C ou de 81°C. Variance au point H : La règle des phases donne la variance d'un système thermodynamique. v = c+q+1-j c : nombre de constituants indépendants ( nombre de constituants - nombre de réactions chimiques indépendantes entre ces constituants) c = 2 ; q=0 ; la pression n'est pas un facteur pouvant modifier l'équilibre.( isobare) j : nombre de phases présentes. j = 3 En ce point, la composition de
chaque phase et la température sont bien
déterminées.
Potentiel chimique d'une espèce i :
hi : enthalpie molaire partielle ; si : entropie molaire partielle. Potentiel chimique du cyclohexane m2V, dans la phase vapeur supposée parfaite en fonction de m2*V, potentiel du cyclohexane gaz parfait pur sous la pression totale P et à la température T, et en fonction de x2V, fraction mùolaire du cyclohexane dans la phase vapeur : m2V = m2*V + RT ln x2V. de même potentiel chimique du cyclohexane m2V, dans la phase liquide : m2L = m2*L . Condition d'équilibre entre les différentes phases pour le cyclohexane : m2V =m2L ; m2*V + RT ln x2V= m2*L ; m2*L -m2*V = RT ln x2V. Evolution de la fraction molaire du cyclohexane dans la phase vapeur ( pour une température comprise entre 342,5 et 383,8 K) :
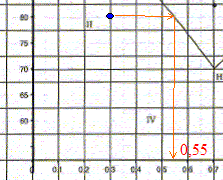
puis intégrer entre 353,8 K °C soit ( température d'ébullition du cyclohexane pur) et T : DvapH20 / R [1/353,8 - 1/T] = ln x2V . En prenant x2V = 0,9 et la température correspondante T= 351,8 K sur le graphe on peut évaluer DvapH20 : DvapH20 = R ln x2V / [1/353,8 - 1/T] = 8,32 ln 0,9 / [1/353,8 - 1/351,8] = 54 kJ/mol. |
|||
|
|
|||
|
|