|
chimie ; concours Agrégation interne 2006 : critère d'évolution spontané ; loi de Hess. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Nom de l'ester obtenu, en nomenclature systématique : CH3-COO-CH2-CH2-CH2-CH2-CH3 étanoate de pentyle. Expression et valeur de la constante K de l'équilibre : A + P = E + H2O ; K= aE, éq aH2O, éq / (aA, éq aP, éq) = nE, éq nH2O, éq / (nA, éq nP, éq) avec nE, éq = nH2O, éq =1,32 mol et nA, éq = nP, éq = 2-1,32 = 0,68 mol K= (1,32/0,68)2 = 3,77. Enthalpie standard DrH°de la réaction à 298 K : enthalpie standard DdisH° de dissociation de liaison à 298 K :
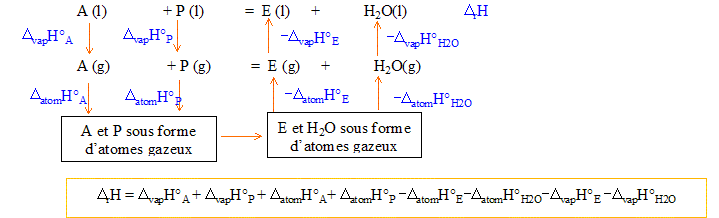
DatomH°A=3DdisH°(C-H) + DdisH°(C=O) +DdisH°(O-H) +DdisH°(C-O)+DdisH°(C-C) DatomH°P=11DdisH°(C-H) +4DdisH°(C-C) +DdisH°(O-H) +DdisH°(C-O) DatomH°E=14DdisH°(C-H) +5DdisH°(C-C) +2DdisH°(C-O) + DdisH°(C=O) DatomH°H2O=2DdisH°(O-H) DatomH°A+DatomH°P-DatomH°E-DatomH°H2O=0 kJ/mol DvapH°A+DvapH°P-DvapH°E-DvapH°H2O= 41,6+52,2-43,9-44 = 5,9 kJ/mol DrH° = 5,9 kJ/mol endothermique. en conséquence une élévation de température, à pression constante, déplace l'équilibre dans le sens direct.
enthalpie standard : DrG°
= -RT ln H = -8,32*298 ln 3,77 = -3,29 kJ/mol DrG°
=DrH° -
TDrS° DrS°
=(DrH°-DrG°)
/ T = (5,9+3,29)/298 = 0,0308 kJ mol-1
K-1 =
30,8 J
mol-1
K-1. Evolution de l'équilibre : quotient initial Qi ( juste avant l'ajout d'acide) : Qi = nE, i nH2O,i / (nA, i nP, i) Qi = 1,32*1,32/ (2,68*0,68) = 0,96 Le quotient initial étant inférieur à la constante d'équilibre, l'équilibre se déplace dans le sens direct. Composition de l'équilibre :
3,77 (2,68-xéq)(0,68-xéq) = (1,32+xéq)2 la résolution donne xéq = 0,36 mol |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|