|
chimie : cinétique d'un échange de ligands ; concours Agrégation interne 2006 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
[Co(H2O)(NH3)5]3++ SCN- --->[Co(SCN)(NH3)5]2++ H2O on note C1 : [Co(H2O)(NH3)5]3+ et C2 : [Co(SCN)(NH3)5]2+ La longueur d'onde utilisée est 497 nm, pour laquelle la différence des coefficients d'extintion molaire des deux complexes est maximale. La longueur de la cuve utlisée est l. La première série de mesures est réalisée à 70°C avec [ C1]0=3,30 10-3 mol/L et [SCN-]0=0,400 mol/L
vitese de la réaction : v = k [ C1]a[SCN-]b [SCN-] >> [ C1]0 ; [SCN-] peut être considéré comme constant. vitesse de la réaction dans ces conditions : v = k' [ C1]a avec k'= k [SCN-]b
A= (e 1[ C1] + e2[ C2] ) l. (1) Expression de l'absorbance en
fonction de e
1,
e2,
l,
[ C1], Aoo : de plus Aoo = e2 l [ C2]fin = e2 lxfin =e2 l[ C1]0 soit [ C1]0 =Aoo /(e2 l) et [ C1]= [ C1]0 -x = [ C1]0 -[ C2] ; [ C2] = [ C1]0 -[ C1] = Aoo /(e2 l)-[ C1] repport dans (1) : A= (e 1[ C1] + e2( Aoo /(e2 l)-[ C1]) ) l. A= (e 1-e2)[ C1]l + Aoo. [ C1] =(A- Aoo) / ((e 1-e2)l) ; d[ C1]/dt = 1/ ((e 1-e2)l) dA/dt v = -d[ C1]/dt = k'(A- Aoo)a/ ((e 1-e2)l)a -1/ ((e 1-e2)l) dA/dt = k'(A- Aoo)a/ ((e 1-e2)l)a dA/dt =- k'(A- Aoo)a/ ((e 1-e2)l)a-1
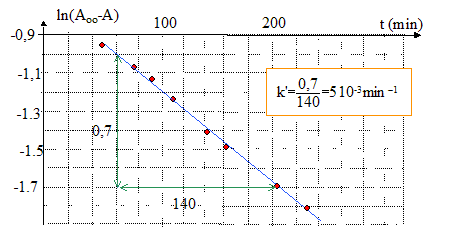
dA/dt =- k'(A- Aoo) ; dA /(A- Aoo) = -k' dt par intégration : ln(A- Aoo) = -k't + constante ; à t=0 , A=A0. d'où : ln[(A0- Aoo) /(A- Aoo)] = k't ; ln[(Aoo- A0) /(Aoo- A)] = k't ; ln (Aoo-A) = -k't +ln (Aoo-A0) tracer le graphe ln (Aoo-A) = f(t) ; droite de pente k'.
D'autres séries de mesures ont été effectuées dans les mêmes conditions de température à partir des solutions suivantes préparées dans des fioles jaugées de 100 mL et complétées à 100 mL avec de l'eau déminéralisée.
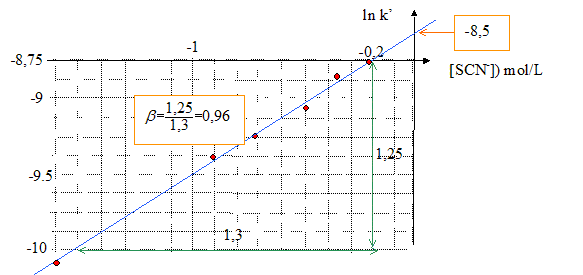
Rôle de la solution de perchlorate de sodium : elle garde constante la force ionique de chaque solution. Ordre partiel de la réaction par rapport à SCN- : k'= k [SCN-]b ; ln k' = ln k + b ln [SCN-] tracer la courbe ln k' = f([SCN-]) ; droite de pente b et d'ordonnée à l'origine ln k.
ln k = -8,5 d'où k = 2 10-4 s-1 L mol-1. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||