|
chimie : réactions prépondérantes ; tampon ammoniacal ; pouvoir tampon ; Agrégation interne 2006 |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
Une solution tampon acido-basique contient un couple acide / base faible tel que les concentrations de la forme acide et de la forme base conjuguée soient identiques : le pH est alors égal au pKa du couple. Une solution tampon modère les variations de pH lors de l'ajout modéré de base ou d'acide, lors d'une dilution. Constante d'acidité d'un couple acido-basique : c'est la constante de l'équilibre suivant : AH + H2O = A- + H3O+ ; Ka = [H3O+][A-] /[AH] pour les osolutions diluées idéales ; sinon il faut remplacer les concentrations par les activités. Les couples de l'eau sont : H3O+ /H2O ( pKa = 0) et H2O / HO- ( pKa = 14 à 25 °C) Définition du pH : pH= - log aH3O+ = - log
(g
[H3O+] ) : g
tend vers 1 en solution très
diluée.
NH3+ H3O+ = NH4+ +H2O ; K = [NH4+]éq /([H3O+]éq[NH3]éq ) = 1/Ka = 109,2 = 1,58 109 quantitative or [H3O+]éq = 10-9,5 = 3,16 10-10 mol/L d'où : [NH4+]éq /[NH3]éq = 1,58 109* 3,16 10-10 = 0,50.
en conséquence : CVa très proche de xéq et [NH4+]éq = CVa/ V = 0,02 Va/ 0,1 = 0,2 Va. [NH3]éq =(CVb-xéq) / V = (CVb-CVa/ V = C/V ( Vb-Va)= 0,02/*0,1 ( Vb-Va) = 0,2( Vb-Va) or [NH4+]éq /[NH3]éq =0,5 ; Va / ( Vb-Va) = 0,5 ; Vb= 3Va. Or Vb+Va = 100 mL ; Va = 25 mL ; Vb = 75 mL.
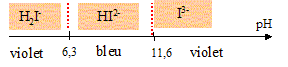
On souhaite doser une solution de nitrate de magnésium. Le mode opératoire est le suivant : Placer la solution de sel dissodique de l'éthylènediamminetétracétique ( noté EDTA) de concentration CEDTA=0,0504 mol/L dans une burette au 1/20 de mL. Dans un becher verser une prise d'essai de V1 = 25,00 mL de la solution de nitrate de magnésium, 10 mL de tampon ammoniacal, 0,1 g ( une pointe de spatule ) de NET dans NaCl. Verser la solution d'EDTA jusqu'à l'équivalence. Soit Véq le volume équivalent. Procéder à deux dosages concordant. Le dosage a une précision évaluée à 1%. NET : Noir Eriochrome T, triacide dont une partie du diagramme de prédominance est le suivant :
Ligand I3- du NET
: Formule semi-développée de l'acide éthylènediamminetétracétique :
H4Y est quasiment insoluble dans l'eau : on utilise donc le sel disodique de l'EDTA. Y4- : ligand hexadentate ; les complexes formés avec Y4- sont de type AX6 ; cela correspond à une structure octaédrique. Réactions prépondérantes ayant lieu dans le bécher : Ce sont les réactions (entre les espèces initialement majoritaires ) possédant les constantes d'équilibre les plus grandes. Avant ajout EDTA : Mg2+ +HI2- + NH3 = [MgI]- + NH4+(1) K = [[MgI]- ][ NH4+] / ([Mg2+][HI2-][NH3]) [MgI]- + H+ = Mg2+ + HI2-avec Kd = ([Mg2+][HI2-] / ( [[MgI]- ] [H+]) soit [[MgI]- ]/ ([Mg2+][HI2-]) = 1/(Kd[H+]) NH4+= NH3+ H+ avec Ka = [NH3] [H+]/ [ NH4+] soit [ NH4+] / [NH3] = [H+] / Ka par suite K = 1/(KaKd) = 109,2 *107=1016,2. [MgI]- : donne la teinte rouge violacée à la solution EDTA ajouté en défaut : Mg2+ +H2Y2- + 2NH3 = [MgY]2- + 2NH4+. (2) K1=[[MgY]2- ][ NH4+]2 / ([Mg2+][H2Y2-][NH3]2 ) [MgY]2- + 2H+ = Mg2++H2Y2-] avec Kd1 = [Mg2+][H2Y2-] / ([[MgY]2- ][H+]2) K1= 1/(Kd1Ka2) = 108,7 * 1018,4 = 1027,1. ( 2 ) est prépondérant par rapport à (1) [MgY]2- étant incolore, la solution reste rouge violacée. Juste avant l'équivalence : Mg2+ devient minoritaire [MgI]- + H2Y2- + NH3 = [MgY]2- + NH4+ + HI2- (3) = (2) -(1) K2=[[MgY]2- ][ NH4+] [HI2-] / ([[MgI]- ][H2Y2-][NH3] ) = K1/K =1027,1 / 1016,2 = 1010,9. HI2- : teinte bleue A l'équivalence on observe un changement de teinte : passage du rouge violacé au bleu. A l'équivalence d'un dosage les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Si Véq = 10,35 mL calcul de [Mg2+] d'après (2) : n(Mg2+) = n(H2Y2-) ; [Mg2+]*25 =0,0504*10,35 ; [Mg2+] =0,0209 mol/L.
La solution tampon préparée ci-dessus a un pouvoir tampon b= 7,7 10-3 mol/L. or Mg2+ +H2Y2- + 2NH3 = [MgY]2- + 2NH4+. (2) La quantité de matière de NH4+ augmente de 2n(H2Y2-) = 2 CEDTA Véq = 2*0,0504*10,35 10-3 = 1,04 10-3 mol dans 25+10,35 +10= 45,35 mL D[NH4+] =1,04 10-3 / 45,35 10-3 = 0,023 mol/L Or NH3+ H+ = NH4+ ; l'ion H+ provient de la solution d'EDTA Tout ce passe comme si la solution d'EDTA libérait 0,023 mol/L d'ion H+ dans la solution. Pouvoir tampon : pouvoir tampon b = |DC / D pH| en molL-1. il mesure la variation de pH lors de l'addition d'une quantité DC molL-1 d'acide fort ou de base forte. DpH = DC / b= 0,023 /7,7 10-3 = 3 DpH est trop grande :
la solution tampon utilisée ne
joue plus le rôle de solution tampon.
|
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|
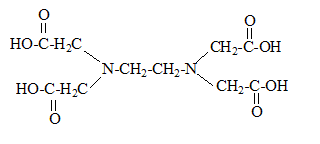 noté
H4Y
noté
H4Y