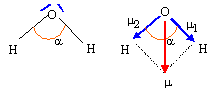|
enseignement, chimie, agrégation interne 2006 : l'eau est un solvant polaire, protique, dissociant |
|||
|
|||
|
nombre de protons dans le noyau d'un atome ou d'un ion d'un élément chimique. Configurations électroniques des atomes d'hydrogène et d'oxygène dans leur état fondamental : O : 1s2 2s2 2p4 ; H : 1s1. Règle de Klechkowski : Les orbitales atomiques sont classées d'après leur énergie : celle-ci croît avec les valeurs croissantes des nombres quantiques n+l ; à égalité de valeur, l'énergie augmente avec n. Electrons de valence : Ce sont les électrons externes pour lesquels le nombre quantique principal n est le plus élevé ; il faut aussi prendre en compte les électrons d'une sous couche incomplète. Schéma de Lewis d'un atome : Dans ce type de schéma, seuls les électrons
de valence sont représentés ; un tiret
correspond à un doublet ( deux électrons,
orbitale occupée) ; un point correspond à un
électron célibataire. Ces deux atomes possèdent des électrons célibataires dans leur état fondamental : ce sont donc des radicaux. Isotopes de l'élément hydrogène : hydrogène 11H ; deutérium 21H ; tritium 31 H. Schéma de Lewis de la molécule d'eau
: géométrie de la molécule d'eau : modèle VSEPR type AX2E2 : 2 paires liantes et deux doublets non liants autour de l'oxygène, atome central. Ces 4 paires se disposent autour de l'atome central, de telle manière que les répulsions soient minimales. La molécule d'eau à la forme d'un V :
l'angle est inférieur à 109 ° 28 , la
répulsion entre les doublets non liants étant
plus importante que la répulsion entre les doublets
liants.
Le moment dipolaire de cette molécule, noté PH2O vaut 1,85 D. L'expérience suivante met en évidence ce moment dipolaire : Une règle en plexiglas est électrisée par frottements ; on l'approche d'un mince filet d'eau coulant du robinet : le filet d'eau est dévié. Pourcentage du caractère ionique de la liaison OH : dO-H = 96 pm
m1 = m2 ; m = 2 m1 cos (½a) ; m1 =m / ( 2cos (½a)) = 1,85 / (2*cos (104,5 / 2 )) = 1,52 D. or 1 Debye = 1D = 3,33 10-30 C m d'où m1 =1,52* 3,33 10-30 = 5,06 10-30 C m Pourcentage de caractère ionique : m1
/( e dOH) = 5,06 10-30 / (1,6
10-19 * 96 10-12) = 0,329 (
33
%).
L'énergie associée à ces forces est de 10 à 100 fois plus faible que l'énergie associée à une liaison covalente : c'est à dire de l'ordre de 0,1 à 10 kJ/mol. On distingue sous cette appellation trois type d'interactions : dipôle permanent- dipôle permanent ( Keesom) ; dipôle permanent - dipôle induit ( Debye) ; dipôle induit - dipôle induit ( London ) Cette dernière est toujours présente,
étant liée à la polarisabilité
des molécules.
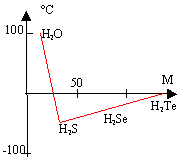
Cette liaison est plus intense que l'interaction de van der Walls : son énergie est de l'ordre de 30 kJ/mol. C'est une liaison entre un atome d'hydrogène et un atome électronégatif ( O, N, F) Conséquences : Température
d'ébullition normale en fonction de la masse molaire
des hydrures. Les
températures d'ébullition augmentent
avec la masse molaire sauf pour l'eau où la
valeur est anormalement élevée.
Explication : présence de liaisons
hydrogènes intermoléculaires formant
des associations moléculaires. D'autre
part H2Te est plus polarisable que
H2Se ; les interactions de London seront
plus grandes dans H2Te que dans
H2Se : la température
d'ébullition de H2Te sera plus
grande que celle de
H2Se. Cette solubilisation d'un composé A ( solide, liquide, gaz) peut être modélisée par : A pur = A dissous. La solubilité du diiode dans l'eau est 0,3 g/L et, à la même température, 140 g/L dans le benzène. Une molécule apolaire ( comme I2) est très soluble dans un solvant apolaire ( benzène) ; par contre une molécule apolaire est peu soluble dans un solvant polaire ( eau). De plus, entre le diiode et le benzène, noyau riche en électrons délocalisés, il s'établit un complexe de transfert de charge ( I2 accepteur d'électrons). Le saccharose, molécule
polaire est soluble dans l'eau, solvant polaire ; le
saccharose, molécule polaire est insoluble dans le
benzène, solvant apolaire.
La mise en solution d'une molécule polarisée d+A--Bd- peut être modélisée par deux étapes successives : étape 1 : ionisation, solvatation : d+A--Bd- = [A+ ....B-] Plus le solvant est polaire, plus il est ionisant. Les solvants du type bases de Lewis ( riches en doublets électroniques) solvatent les cations, déficitaires en électrons. étape 2 : dispersion des ions en solution : [A+ ....B-] = A+(aq) + B-( aq) Des force attractives de Coulomb existent entre la paire d' ions : f = q q' / ( 4pe0er d2) Plus la constante diélectrique er du solvant est importante, plus les ions sont facilement dispersés en solution. Dans le cas de l'eau
er
= 78,4 ; dans le cas de l'acide éthanoïque
e
r = 6,1 : ce solvant
polaire, protique est beaucoup moins dissociant que l'eau.
La basicité ( phénomène thermodynamique : équilibre entre une base et son acide conjugué ) Une base est une espèce susceptible de céder un doublet. La nucléophilie ( phénomène cinétique : mesure de la vitesse d'une réaction entre un nucléophile et un électrophile) aptitude d'une espèce
à attaquer un site déficitaires en
électrons.
HO- > H2 O HO- base plus forte que l'eau ; HO- meilleur nucléophile que l'eau ( basicité est nucléophilie varient souvent dans le même sens) HO- dans le méthanol est comparable à CH3O- dans le méthanol. HO- > (CH3)3CO- cet ion , plus basique que HO- est très encombré. HO- < I- , ce dernier est un ion polarisable, c'est donc un bon nucléophile. |
|||
|
|
|||
|
|