|
Agrégation 2006 : les principes de la thermodynamique |
|||
|
|||
|
Enoncé du premier principe ( pour un système fermé ) ou pricipe de conservation de l'énergie : Un système fermé évolue de l'état 1 à l'état 2 sous l'action des transferts mécanique Wext et thermique Q : Le transfert mécanique Wext ne tient compte que des travaux des forces extérieures. DE + DU = Wext+Q avec DE : variation de l'énergie mécanique et DU : variation de l'énergie interne. Enoncé du théorème de l'énergie cinétique, entre deux instants pour un système fermé : La variation de l'énergie cinétique entre deux intants de dates t1 et t2 est égale à la somme des travaux des forces extérieures et intérieures agissant entre ces deux instants. DEc = Wext+Wint. par suite DU=
Q-Wint : l'énergie interne reste constante
s'il ni a ni échange thermique, ni force
intérieure.
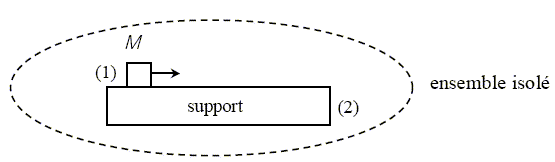
solide (1) : le théorème de l'énergie cinétique s'écrit : 0-½Mv02 = - mMgL le premier principe s'écrit : DE1+DU1= - mMgL +Q1 d'où : DU1=Q1 support (2) immobile : le théorème de l'énergie cinétique s'écrit : 0 = 0 le premier principe s'écrit : DE2+DU2= 0 +Q2 d'où : DU2=Q2 ensemble isolé : le théorème de l'énergie cinétique s'écrit : 0-½Mv02 = - mMgL le premier principe s'écrit : DE1+DU1+DU2= 0 ; -½Mv02 +DU1+DU2= 0 ; -½Mv02 +Q1 +Q2 =0 ; ½Mv02 = Q1 +Q2 Le travail des frottements convertit l'énergie cinétique en énergie thermique : la température du solide et du support s'élève.
La puissance mise en jeu est P=F v = 10*2 = 20 watts = 20 joules par seconde. Volume de la couche à chauffer : 200*0,1 = 20 cm3 ; le corps humain étant essentiellement constitué d'eau, la masse de cette couche est de l'ordre de 20 g = 0,02 kg Energie transférée à cette couche à chaque seconde : 20 J = 0,02 cDq ; Dq = 20/(0,02*4180)=0,24 degré En se frottant les mains pendant 1 min, la température s'élève d'environ 14 degrés. |
|||
|
Enoncé pour un système isolé : L'entropie d'un système isolé ne peut qu'augmenter jusqu'à une valeur maximale, correspondant à un état d'équilibre. Expression de l'entropie d'un gaz parfait de coefficient g constant en fonction du volume V et de la température T: dS= dU/T+P/T dV avec P/T = nR/V et dU=nCvdT = nR/(g-1) dT d'où dS= nR/(g-1) d (lnT) + nR d(ln V) par intégration : S-S0= nR[1/(g-1) ln(T/T0) + ln(V/V0)] Expression statistique de l'entropie : ( Boltzmann) S= k ln W. W : nombre de micro-états correspondants à un état macroscopique donné. Le système isolé doit posséder une énergie constante. Une détente de Joule Gay-Lussac dans le vide double le volume du gaz parfait : détente adiabatique irréversible : le transfert thermique Q est donc nul. Système indéformable : le travail des forces de pression W est nul en conséquence DU = 0 ; l'énergie interne est constante. Or l'énergie interne d'un gaz parfait ne dépend que de la température : si DU = 0, la température du gaz reste constante S-S0= nR ln(V/V0)= nR ln 2.
Si de l'huile est mise dans l'eau, elle remonte à la surface pour former deux phases bien distinctes ( l'ordre des particules s'accroît). Le processus étant exothermique, de l'énergie est cédée dans le milieu extérieur ( accroissement du désordre énergétique : ce dernier l'emporte ) L'volution du système est en accord avec le second principe.
A 0 K, l'entropie d'un corps pur est nulle. Les
particules sont immobiles ; il existe un seul
micro-état ; W=1 et
S= k ln
W donc
S=0.
|
|||
|
|