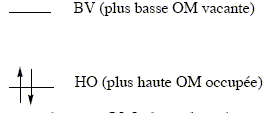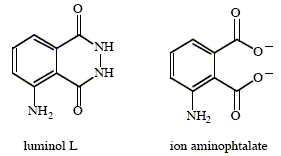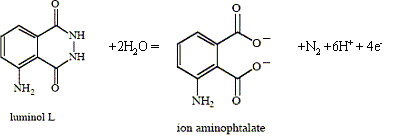|
Agrégation 2006 : conversion d'énergie chimique en énergie lumineuse : chimiluminescence |
|||
|
|||
|
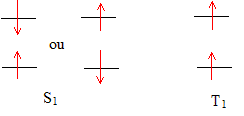
état fondamental - états excités : Soit une molécule M, dont le diagramme des orbitales moléculaires (OM) présente le remplissage suivant à l'état fondamental ( état singulet S0) :
Deux états excités sont accessibles à ces électrons ( S1 : état singulet de spin total nul et T1 : état triplet de spin égal à 1 de plus basse énergie)
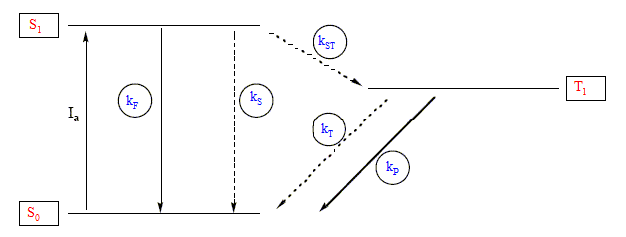
On considère l'irradiation d'une solution de composé M. Après absorption d'un photon, la molécule M passe de l'état fondamental singulet S0 à l'état singulet excité S1. A partir de S1, on distingue différents processus : - une fluorescence ( kF) - un processus non radiatif S1--->S0 ( kS) - une conversion intersystème, transition non radiative S1--->T1 ( kST) A partir de T1, on distingue différents processus : - une phosphorescence ( kP) - un processus non radiatif T1--->S0 ( kT) Tous ces processus obéissent à une cinétique du premier ordre, dont la constante correspondante apparaît entre parenthèses. Sur le diagramme de Jablonski ( ci-dessous), les flèches pleines correspondent aux processus radiatifs ( avec émission d'un rayonnement).
Ia est
l'intensité lumineuse absorbée par
l'échantillon ; cette absorption se fait à la
vitesse va.
On définit le rendement quantique F d'un processus de désexcitation comme le rapport v/va du nombre de molécules désexcitées par ce processus ( par unité de temps et de volume) sur le nombre de molécules excitées initialement ( par unité de temps et de volume), v étant la vitesse de ce processus. On note [S1] et [T1] les concentrations moléculaires de l'espèce M respectivement dans l'état singulet S1 et dans l'état triplet T1. rendement quantique de la fluorescence : FF=kF[S1]/va rendement quantique de la phosphorescence : FP=kP[T1]/va rendement quantique de la conversion intersystème : FST= kST[S1]/va Les états excités S1 et T1 peuvent être considérés comme des intermédiaires à très courte durée de vie. d[S1] /dt=0 =va-(kF+kST+kS)[S1] d'où [S1] /va=1/(kF+kST+kS) par suite : FF=kF/(kF+kST+kS) ; FST= kST/(kF+kST+kS) d[T1] /dt=0 = kST [S1]-(kP+kT)[T1] ; kSTva/(kF+kST+kS)=(kP+kT)[T1] ; [T1]/va=kST/[(kF+kST+kS)(kP+kT)] par suite : FP=kPkST/[(kF+kST+kS)(kP+kT)] La concentration de l'espèce M est sans influence sur les rendements quantiques.
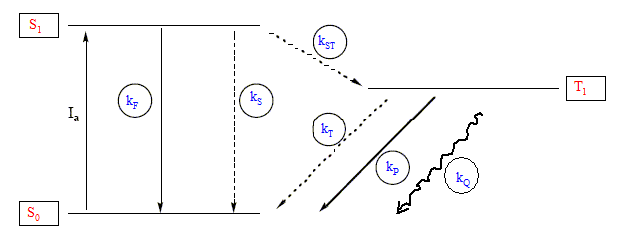
Désactivation par quenching : <aux processus décrits ci-dessus s'ajoute un processus élémentaire bimoléculaire mettant en jeu une molécule Q "quencher") qui, par collision avec M l'état triplet la désactive selon : M*(T1)+Q---> M(S0)+Q* (kQ)
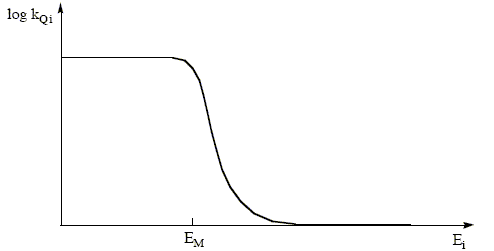
On note FPQ le rendement quantique de la phosphorescence en présence de Q. d[T1] /dt=0 = kST [S1]-(kP+kT+kQQ)[T1] ; kSTva/(kF+kST+kS)=(kP+kT+kQQ)[T1] ; [T1]/va=kST/[(kF+kST+kS)(kP+kT)+kQQ] par suite : FPQ=kPkST/[(kF+kST+kS)(kP+kT+kQQ)] FP/FPQ=(kP+kT+kQQ) /(kP+kT)=1+kQQ /(kP+kT) FP/FPQ= f(Q) : équation d'une droite ( droite de "Stern - Volmer") de coefficient directeur kQ/(kP+kT). Cette droite permet de déterminer kQi pour différents quencher Qi ; on trace ensuite la courbe log kQi =g(Ei) pour chaque quencher Qi, Ei étant l'énergie de son état excité.
Au cours de la collision, le quencher gagne l'énergie ET1-ES0 à condition que Ei soit inférieure à ET1-ES0 EM est la valeur
maximale de Ei correspondant à un
transfert énergétique réalisable.
|
|||
|
Un processus est dit chimiluminescent lorsqu'il conduit à l'apparition d'une espèce dans un état électronique excité et que le retour de cette espèce à l'état fondamental s'accompagne de l'émission d'un photon. Oxydation chimiluminescente du luminol : On mélange deux solutions aqueuses, l'une d'eau oxygénée et l'autre, tamponnée à pH=9, contenant du luminol (L), des ions cuivre (II) et de l'ammoniac. On observe en l'agitant, l'émission d'une lumière bleue. Sont consignées ci-dessous quelques observations expérimentales : - En milieu aprotique, il suffit d'une base forte et d'oxygène moléculaire pour provoquer la réaction chimiluminescente, avec un maximum d'absorption à 485 nm. - - En solant protique, la réaction nécessite une base, de l'oxygène moléculaire ou un peroxyde et un oxydant auxiliaire comme les ions hypochlorite ClO-, tétrammine cuivre (II) Cu(NH3)42+. - On a montré que c'est le radical anion O2.- qui permet la réaction. - La longueur d'onde de l'émission observée dans l'expérience décrite se situe vers 430 nm. - Le spectre de fluorescence de l'ion aminophtalate présente un maximum vers 430 nm. Formules des espèces impliquées :
Demi-équation électronique de formation du radical anion O2.- à partir de l'eau oxygénée H2O2 : H2O2 = O2.- + 2H++ e-. Rôle des ions cuivre (II) et de l'ammoniac : Cu2+ + 4 NH3 = Cu(NH3)42+. Ce dernier oxyde l'eau oxygénée en radical anion O2.- Le processus de chimiluminescence peut être décrit par les étapes suivantes : L---> B* ( oxydation par l'ion superoxyde) B*---> B + hn. B étant l'ion aminophtalalte ; B* se trouve dans un état excité singulet car il se désexcite par fluorescence. Demi-équation électronique de l'oxydation de L en B :
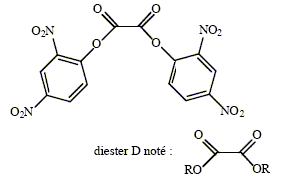
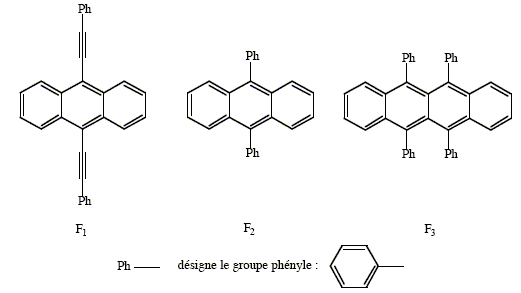
Les bâtonnets lumineux que l'on distribue parfois lors de fêtes e, plein air nocturnes sont constitués d'un tube flexible en matière plastique, renfermant un diester D de l'acide oxalique, un composé Fi( i=1, 2 ou 3) et une ampoule en verre contenant de l'eau oxygénée. En pliant l'ampoule on déclenche un processus chimiluminescent. Figurent ci-dessous les formules
semi-développées des espèces
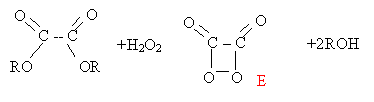
impliquées dans ce dispositif : En présence d'eau oxygénée, les diesters de l'acide oxalique conduisent à la formation d'un composé non isolable, la dioxétanedione notée E.
L'espèce E est formée dans un état excité, mais la coulaue émise dépend de l'espèce Fi : F1 donne une lumière verte, F2 une lumière bleue et F3 une couleur jaune. Fi joue le rôle d'un "quencher". Plus la conjugaison dans une molécule organique est étendue, plus l'écart d'énergie entre les niveaux des orbitales HO et BV est faible. Or E = hc/l : la longueur d'onde du photon émis est d'autant plus grande que la différence d'énergie E est plus faible. Pour F2, la conjugaison met en jeu 26 atomes ; pour F1, la conjugaison met en jeu 30 atomes ; pour F3, la conjugaison met en jeu 42 atomes. d'où les couleurs observées l bleu<lvert<ljaune.
|
|||
|
|