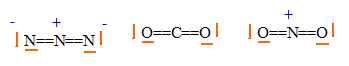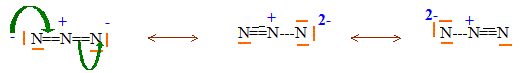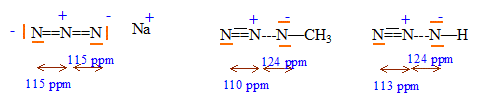|
Agrégation physique chimie ( d'après concours 2006) Le coussin gonflable de sécurité. |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
L'azoture de sodium NaN3 :
Trois réactions se produisent suite à
l'amorçage du détonateur : 10 Na + 2KNO3 ---> K2O+5Na2O+N2 (2) K2O+Na2O + SiO2 ---> K2Na2SiO4 poudre de verre amorphe (3) Toutes les espèces sont solides sauf le diazote.
corrigé L'azoture de sodium NaN3 : Structure de Lewis de l'ion azoture N3- :
La molécule CO2 et un ion NO2+ sont isoélectroniques de N3-. La structure de Lewis proposée pour N3- ( symétrie par rapport à l'azote central ) est en accord avec la longueur identique des liaisons. Par contre une disymétrie de structure entraîne des longueurs de liaisons différentes ; écrivons les formules mésomères pour l'ion azoture :
Le caractère ionique de la liaison X-N : Les éléments sodium et azote ont des électronégativités très différentes : NaN3 possède une structure ionique. Par contre les éléments carbone, hydrogène et azote ont des électronégativités assez proches : la liaison C-N dans CH3N3 et la liaison H-N dans HN3 auront un caractère covalent plus marqué.
Une méthode de synthèse de l'azoture de sodium consiste à mélanger de l'amidure de sodium et du nitrate de sodium à 175°C. 3NaNH2 + NaNO3 ---> NaN3 + 3NaOH + NH3. Nombre d'oxydation moyen de l'élément azote dans chaque espèce azotée : NaNH2 : 1+n +2 = 0 soit n = -3 ou (-III) ; NH3 : n+3 = 0 soit n = -3 ou (-III) NaNO3 : 1+n-2*3 = 0 soit n = 5 ou (+V) NaN3 : 1+3n = 0 soit n =
-1/3 Il sagit d'une rétrodismutation : les nombres d'oxydation initiaux de l'élément azote sont -III et +V ; le nombre d'oxydation final de l'élément azote -1/3 est compris entre -III et +V. L'amidure de sodium joue un
deuxième rôle : celui de base ; il contribue
à la formation de l'ammoniac NH3. NaNO3 et NaN3 ont des solubilités voisines à 298 K et à 373 K. Si le réactif en défaut estNaNO3, ce dernier disparaît. NaNH2 en excès est transformé en NH3, soluble dans l'eau ; NaOH est également très soluble dans l'eau ; par contre NaN3 est peu soluble dans l'eau : Cette méthode de
purification porte le nom de "précipitation
sélective".
Trois réactions se produisent suite à
l'amorçage du détonateur : 10 Na + 2KNO3 ---> K2O+5Na2O+N2 (2) K2O+Na2O + SiO2 ---> K2Na2SiO4 poudre de verre amorphe (3) Toutes les espèces sont solides sauf le diazote. Quantité minimale d'azoture de sodium nécessaire au gonflement d'un sac de 70 L à 300 K et sous 1 bar : n= PV/(RT) avec P = 105 Pa ; V= 0,07 m3 ; T= 300K; R=8,32 SI. n = 105*0,07/(8,32*300) = 2,80 mol Or d'après les réactions (1) et (2), il se forme 16 moles de N2 à partir de 10 moles de NaN3 d'où : n(NaN3) = n/1,6 = 1,75 mol masse (g) = masse molaire (g/mol) * quantité de matière (mol) m = (23+3*14)*1,75 = 113 g. Volume (mL) correspondant = masse (g) / masse volumique (g/mL)= 113 / 1,85 = 61 mL. Ordre de grandeur de la pression à laquelle il faudrait comprimer, dans un réservoir de 500 mL, la quantité de diazote nécessaire au gonflement du sac de 70 L sous 1 bar à 300 K : P= nRT/V avec n=2,8 mol; T=300 K et V= 5 10-4 m3 ; P= 2,8*8,32*300/5 10-4 = 1,4 107 Pa = 140 bars. Intérêt d'utiliser un dispositif chimique plutôt qu'un dispositif de libération d'un gaz sous pression : Le volume de stockage "chimique" est 8 fois plus petit que le volume de stockage d'un gaz comprimé. Intérêt de provoquer les réactions (2) et (3) après explosion de l'azoture : Le sodium formé réagit violemment avec l'eau et est inflammable à l'air. K2O et Na2O sont des oxydes basiques conduisant, en présence d'eau, à des bases fortes, corrosives. |
|||||||||||||||||||||||||
|
|