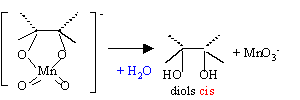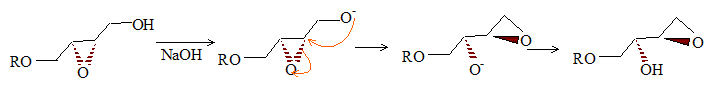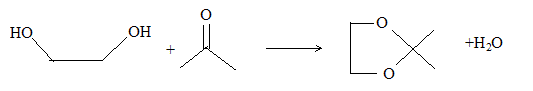|
Agrégation 2005 : les epoxydes, les diols |
|||
|
|||
|
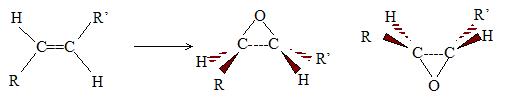
L'acide métachloroperoxybenzoïque ( m-CPBA), le dioxygène en présence de catalyseur à base d'argent, permettent de passer d'un alcène à l'époxyde. Le pont "oxygène se forme soit au dessus du plan de la double liaison, soit en dessous : en conséquence, à partir de l'alcène suivant, plusieurs énantiomères sont obtenus.
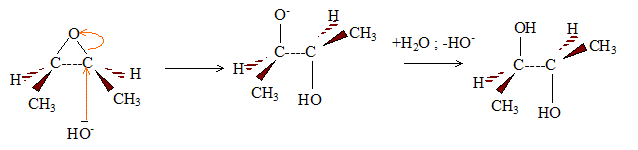
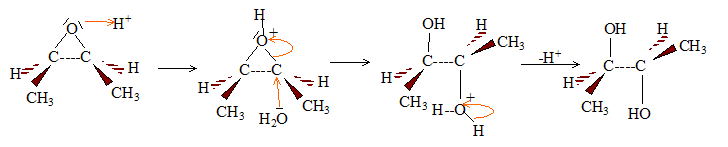
Par hydrolyse acide ou basique d'un époxyde, on obtient un diol :
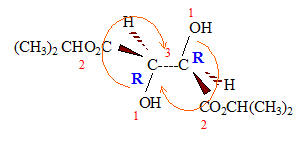
L'attaque initiale de HO- est équiprobable sur chaque carbone : on obtient donc les deux énantiomères dans la même proportion ( mélange racémioque). En milieu acide l'attaque initiale de H+ porte sur l'atome d'oxygène.
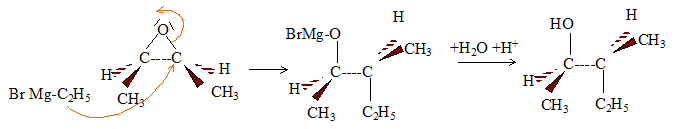
En RMN du proton 1H, ce diol donne trois signaux du fait de la symétrie de la molécule : le signal du proton du groupe OH ( singulet), très déblindé ; le signal des 3 protons du groupe CH3 ( doublet), le moins déblindé ; le signal de l'hydrogène fixé sur le carbone ( quadruplet), déblindé par la présence de l'atome d'oxygène. Par action de l'organomagnésien C2H5-MgBr, suivie d'une hydrolyse, sur un époxyde, on obtient un alcool :
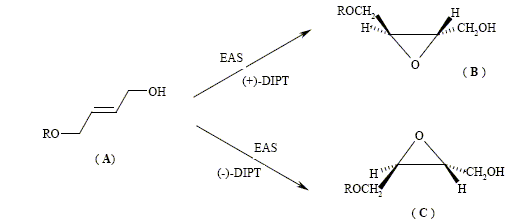
La formule du (+)-tartrate de
diisopropyle est : Le mécanisme de l’époxydation asymétrique de Sharpless (que l’on notera EAS) est complexe : il fait intervenir une association entre le tartrate, le titane, et la fonction alcool de l’alcool allylique ; on ne donnera que le résultat (le rendement est significatif dans chaque cas) obtenu à partir du composé (A) représenté ci-dessous :
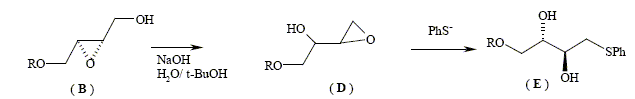
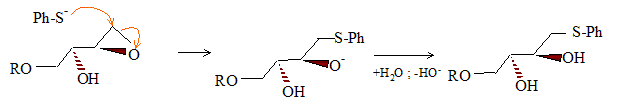
Le stéréoisomère obtenu dépend donc de la nature du DIPT utilisé. La suite est effectuée à partir de (B). Dans la molécule (A), R représente le groupement (C6H5)2CH- que l’on pourra noter Ph2CH où Ph est le symbole du noyau benzénique. Nom de A : (E)-6,6-diphényl-5-oxahex-2-én-1-ol. L’hydrolyse du composé (B) est réalisée en milieu basique, et en présence de PhS-, ion phénylthiolate. On a pu mettre en évidence les transformations successives (réarrangement de Payne) :
La présence du noyau
benzénique augmente l’acidité de Ph-SH
par rapport à un thiol RSH (R étant un
groupement alkyle) : en effet le doublet électronique
présent dans la base conjuguée
Ph-S- est délocalisé sur le noyau
benzénique ; la base conjuguée en sera
d'autant plus stable et en conséquence
l'hydrogène sera plus mobile ( acidité
augmentée)
La réaction d'estérification d'un alcool conduit à l'ester ; l'hydrolyse de l'ester donne l'alcool de départ : en passant à l'ester, on protège la fonction alcool. De même, l'amide est le protecteur la fonction amine ; l'hydrolyse acide de l'amide conduit à l'amine de départ. Le diol est protégé par la formation d’un acétal :
Dans un cas général, la réaction de formation d’un acétal à partir d’une mole d'acétone et de deux moles d’alcool ROH est une réaction équilibrée peu en faveur de l’acétal ; dans le cas ci-dessus (formation d’un acétal cyclique) l’équilibre est beaucoup plus en faveur de l’acétal. Pour déplacer
l'équilibre vers la formation de l'acétal, on
peut utiliser un réactif en excès, ou
éliminer l'un des produits au fur et à mesure
qu'il se forme par distillation.
|
|||
|
|
|||
|
|