|
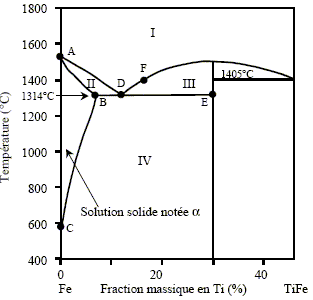
Agrégation 2005 : diagramme binaire fer-titane. |
|||
|
|||
|
Métal de faible densité, offrant une bonne résistance à la corrosion. Métal ayant une résistance mécanique importante et une bonne ductilité. Les deux types d'alliages que l'on peut rencontrer lorsque l'on mélange deux métaux : Si les deux métaux ont des structures proches et des rayons atomiques voisins, il se forme des alliages de substitution. Si l'un des atomes est beaucoup
plus petit que l'autre, alors le plus petit peut occuper des
sites du réseau cristallin de l'autre atome : il se
forme des alliages d'insertion.
|
|||
|
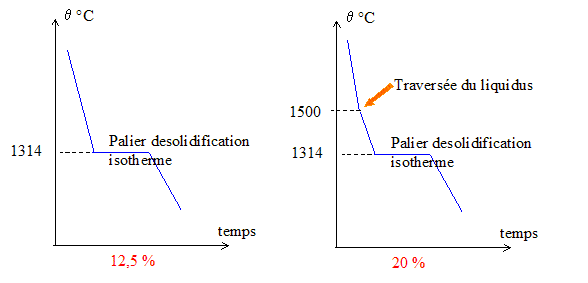
masse molaire en g/mol : M(Ti) = 47,88 ; M(Fe) = 55,85. fraction massique en titane =0,3 = masse de titane / ( masse de titane + masse de fer) = mTi/(mTi+mFe) n(Ti) = mTi /M(Ti) = mTi / 47,88 ; n(Fe) = mFe / M(Fe) = mFe / 55,85 par suite : 0,3 = 47,88 n(Ti)/ ( 47,88 n(Ti) + 55,85n(Fe) ) soit : n(Ti) = 0,5 n(Fe) fraction molaire en titane x(Ti) =n(Ti) / (n(Ti) + n(Fe))= n(Ti) / (n(Ti) + 2n(Ti))= 1/3 Formule chimique de ce composé : TiFe2. Nature des phases en présence dans les domaines I à IV : I : liquide homogène composé de fer et de titane. II : liquide + solution solide a. III : liquide + solide TiFe2. IV avec T < 600°C : Fe et TiFe2 solides. IV avec T > 600°C : solution solide a + TiFe2 solide. Variance d'un mélange de composition en titane comprise entre w(B) = 0,075 et w(E) = 0,30 à la température de 1314°C: La règle des phases donne la variance d'un système thermodynamique. v = c+q+1-j c : nombre de constituants indépendants ( nombre de constituants - nombre de réactions chimiques indépendantes entre ces constituants) c = 2 ; q=0 ; la pression n'est pas un facteur pouvant modifier l'équilibre. j : nombre de phases présentes. j = 3 ( solution solide a, TiFe2, liquide ). v= 0 : la température ne
change pas, la composition de chaque phase est bien
déterminée ; l'eutectique D donne la
composition du liquide.
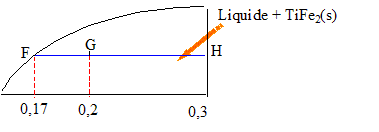
(w(F) = 0,17 ; T(F) = 1400°C). Masse de titane à l'état liquide :
mliquide / m solide = GH/FG = 0,1 / 0,03 = 3,33 ; mliquide = 3,33 m solide ; m solide = 0,3 mliquide mliquide + m solide = 100 mliquide +0,3 mliquide = 100 ; mliquide =100/1,3 = 76,9 g or le liquide ne contient que17% de titane d'où la masse de titane : 76,9*0,17 = 13,1 g.
|
|||
|
|