|
Agrégation 2005 : Structure cristalline hexagonale compact ; maille quadratique ; diffraction des RX |
||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
|
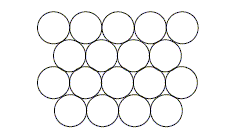
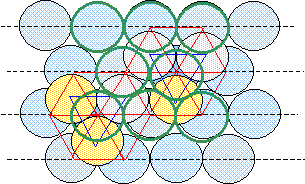
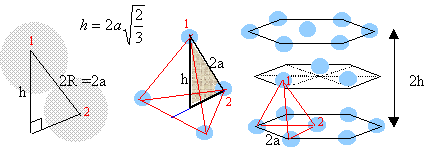
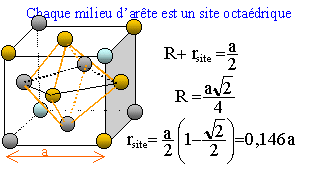
On considère pour l'instant une structure hexagonale compacte formée d'un seul type d'atomes considérés comme des sphères dures de rayon R.
Compléter la figure afin de représenter le mode d'empilement des plans d'atomes successifs dans une telle structure hexagonale compacte. Situer les sites tétraédriques et octaédriques sur cette figure. site tétraèdrique Relations
particulières vérifiées par
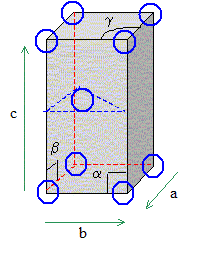
les paramètres d'une telle maille
a=b ; c différe de
a et de b a=b=90°
; g=
120°. 1 noeud : sommet du
parallélépipède construit
à partir des vecteurs de base a, b, c. (
chaque sommet appartient à 8 mailles et
compte pour 1/8) Nombre d’atomes
par maille : 2 chaque atome situé
à un noeud appartient à 8 mailles et
compte pour 1/8 ; l'atome central appartient en
propre à la maille.
rsite = 0,146 a ; a = 4R/2½
d'où rsite = 0,414 R
Les anions plus gros que les cations imposent le type de structure ; les cations occupent les sites laissés vacants. La structure est stable si le rayon d'un cation, occupant un site, est supérieure à la taille du site. rsite = 0,414 Ranion = 0,414*126 = 52 pm ; or r(Ti4+ )=74 pm , la condition de stabilité est vérifiée.
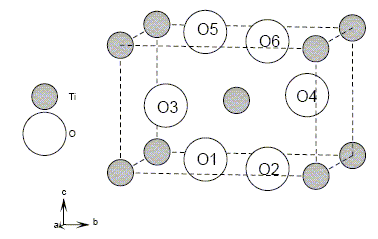
Détail de la structure cristalline de TiO2 rutile. Les atomes de titane sont situés aux sommets et au centre de la maille. Les coordonnées réduites (x/a,y/b,z/c) des atomes d'oxygène sont données dans le tableau. |
||||||||||||||||||||||||||||||||||
|
Montrons que la répartition des atomes donnée par cette figure et par le tableau des coordonnées atomiques est bien en accord avec la formule TiO2. Chaque cation situé à un sommet appartient 8 mailles et compte pour 1/8 ; le cation central appartient en propre à la maille : donc 2 cations par maille. Les anions 01, 02, 05 et 06 appartiennent à 2 mailles et comptent pour 1/2 ; les anions 03 et 04 appartiennent en propre à la maille : donc 4 anions par mailles. Cela correspond à la formule TiO2. Masse volumique de TiO2 : volume de la maille : V=a2c = (459,4 10-12)2* 295,9 10-12 =6,24 10-29 m3. masse des 4 anions et des 2 cations par maille : m = 2 masse molaire TiO2/NA =2 (47,88 + 32) 10-3 / 6,02 1023 =2,65 10-25 kg r=
m/V =2,6510-25 /6,24 10-29 =4,25
103 kg m3.
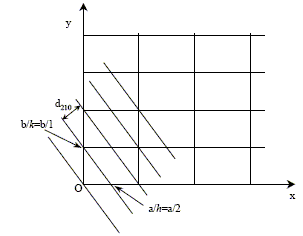
Définition géométrique des indices de Miller. Pour plus de clarté, la figure donne la projectiondu réseau dans le plan (a, b). L'exemple donné correspond aux indices (2 1 0), c'est-à-dire que h=2 et k=1 et l=0. L'un des plans de cette famille coupe les axes en a/h = a/2, b/k = b/1 et est parallèle à c. Dans le cas d'une symétrie quadratique, la distance inter-réticulaire pour la famille de plans (hkl ) est égale à :
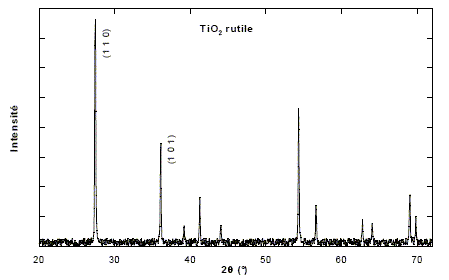
Tous les plans correspondant à la même distance inter-réticulaire contribuent à la raie de diffraction située à l'angle qhkl donné par la relation de Bragg : 2 dhkl sin qhkl= l. Une poudre est formée d'un ensemble de petits cristaux orientés dans toutes les directions. C'est ainsi que toutes les familles de plans (hkl ) peuvent donner une raie de diffraction dans un diagramme de poudre. Dans le cas de TiO2 rutile on obtient le diagramme ci-dessous (la longueur d'onde des rayons X utilisés est l = 154,06 pm).
diagramme de diffraction des rayons-X pour un échantillon de TiO2. L'abscisse est donnée en fonction de l'angle 2q, où q est l'angle de Bragg. Les deux premières raies du diagramme de diffraction correspondent respectivement aux indices (1 1 0) et (1 0 1). Calcul de dhkl : h=k=1 ; l=0 ; a=459,4 pm et c =295,9 pm ; d110 =[(h2+k2)/a2 + l2/c2]-½ = [(1+1)/459,42 ]-½ =459,4 / 2½ =324,84 pm h=l=1 ; k=0 ; a=459,4 pm et c =295,9 pm ; d101 =[(h2+k2)/a2 + l2/c2]-½ = [1/459,42 +1/295,92]-½ =248,76 pm Angle de diffraction (2qhkl) pour ces deux raies : l = 154,06 pm 2 dhkl sin qhkl= l ; sin q110= 154,06 / (2*324,84) =0,237 ; q110=13,71 ° ; 2q110=27,43° sin q101=
154,06 / (2*248,76) =0,310 ; q101=18,04
° ; 2q101=36,08°
Paramètre de maille de cette variété de dioxyde de vanadium : sin q 110 = sin(27,67 / 2 )= 0,2391 d110 = ½l/sin q 110 = 0,5*154,06 / 0,2391 = 322,13 pm or d110 =[2/a2 ]-½ = a/2½ d'où a = 2½d110 =2½*322,13 = 455,56 pm. sin q101= sin(37,09 / 2 )= 0,318. d101 = ½l/sin q101 = 0,5*154,06 / 0,318 = 242,23 pm or d101 =[1/a2 +1/c2]-½ =[1/a2 +1/c2] = 1/d2101 =1/242,232 =1,704 10-5. 1/c2=1,704 10-5-1/a2 = 1,704 10-5-1/455,562 = 1,222 10-5 ; 1/c= 3,496 10-3 ; c = 286,04 pm. Evolution des paramètres de maille observée lorsque l'on passe de TiO2 à VO2 : En se déplaçant dans une même période, on observe une contraction du nuage électronique et une diminution des rayons des ions isoélectroniques ; par suite une diminution des paramètres a, b, c de la maille.
|
||||||||||||||||||||||||||||||||||
|
|