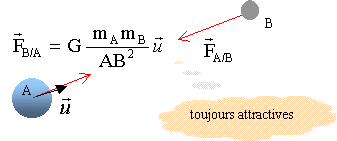|
concentration ; quantité de matière dilution ; gravitation ; principe d'inertie. |
|||||||||||||
|
|||||||||||||
|
La force de gravitation, toujours attractive, exercée entre deux masses ponctuelles, M et m, situées aux points A et B est : - proportionnelle aux masses. - inversemment proportionnelle au carré de la distance AB qui les séparent. En conséquence, si la distance AB diminue ( les masses restant constantes), alors la force augmente. Si M diminue ( m et AB restant constantes), alors la force diminue. Masse du Soleil : MA= 1,99 1030 kg ; distance moyenne Terre-Soleil : AB= 1,50 1011 m; masse de la Terre : MB = 6 1024 kg. constante de gravitation G = 6,67 10-11 S.I.
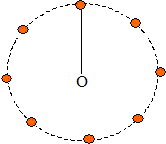
Ces forces sont opposées : elles ont la même valeur notée F : F=6,67 10-11 *1,99 1030 * 6 1024 / (1,50 1011)2 =3,6 1022 N. principe d'inertie : On enregistre le mouvement d'un palet fixé au point O par un fil. Le palet se déplace sur une surface verglacée horizontale.
Le palet est animé d'un mouvement circulaire uniforme : les distances parcourues pendant des durées égales sont égales. Le palet est soumis à son poids, à l'action du support : le poids et l'action du support se neutralisent. D'après le principe d'inertie, le palet n'est pas pseudo-isolé, car son centre d'inertie n'est ni au repos, ni animé d'un mouvement rectiligne uniforme : Le palet est donc soumis à une 3ème force : la tension du fil. Si le fil casse, la tension du fil s'annule : le palet pseudo-isolé est animé d'un mouvement rectiligne uniforme : la trajectoire est la tangente au cercle au point de rupture du fil. équigravité entre la Terre et la Lune : On considère une navette spatiale, de masse 1800 kg, se trouvant entre la Terre et le Lune. On appelle d la distance du centre de la Terre à la navette et D la distance des centres de la Terre et de la Lune. Mterre = 6 1021 tonnes. Mlune = 1 / 83 Mterre. D=380 000 km.
corrigé 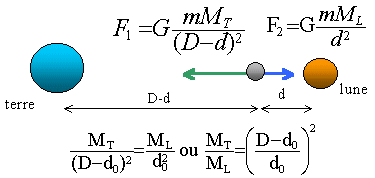
rapport des deux masses (Terre / Lune ) =83 prendre la racine carrée : 9,11 faire les produits en croix d'où : 9,11 d0=D-d0. 10,11 d0 = D d0 =380 000 /10,11 = 37 586 km à peu près le dixiéme de la distance
Terre Lune, plus proche de l'astre le plus
petit.
Un comprimé contient 0,5 g d'aspirine (
C9H8O4) et 0,2 g de
vitamine C ( C6H8O6).
concentration (mol/L) : La concentration de l'éthanol (
C2H6O) dans une bouteille de vin de
volume V= 0,75 L est égale à 2,6 mol/L. M(éthanol) = 2*12+6+16 = 46 g/mol n(éthanol) = concentration (mol/L) * volume (L) = 2,6*0,75 = 1,95 mol masse d'éthanol(g) = nM= 1,95*46 = 89,7 g. Le vin est dilué deux fois : la concentration initiale de l'éthanol est donc divisée par 2 soit 1,3 mol/L.
Masse molaire : M =12 + 4 + 16 + 2*14= 60 g/mol. Une solution de volume V= 0,2 L contient de l'urée dont la concentration est c= 0,5 mol/L. Calculer la quantité de matière d'urée. quantité de matière (mol) =concentration (mol/L) * volume (L) = 0,5*0,2 = 0,1 mol On dissout une masse m= 50 g d'urée dans un volume V= 0,25 L d'eau. calculer la concentration de l'urée. n= m/M= 50/60 = 0,833 mol ; [urée]= n/V = 0,833/0,25 = 3,33 mol/L
Une solution sucrée de volume V= 0,5 L a une concentration en sucre égale à c=0,05 mol/L. On chauffe la solution : 50 mL d'eau s'évapore. Calculer la nouvelle concentration du sucre. Quantité de matière (mol) = concentration initiale (mol/L) * volume (L) =cV= 0,05*0,5 = 0,025 mol concentration finale en sucre (mol/L) = quantité de matière finale (mol) / volume final (L) = 0,025/0,45 =5,56 10-2 mol/L Calculer la masse de sucre ( C12H22O11 )correspondante. m(sucre) = 12*12+22+11*16=342 g/mol masse (g) = masse molaire (g/mol) * quantité de matière (mol) =342*0,025 =8,55 g. A 20°C on peut dissoudre jusquà 2 kg de sucre par litre d'eau. La solution est alors saturée. Calculer la concentration molaire du sucre dans cette solution. n=m/M= 2000 /342 =5,85 mol dans 1 L. Une solution sucrée de volume V= 0,5 L a une concentration en sucre égale à c=0,05 mol/L. On chauffe la solution jusqu'à ce qu'elle soit saturée. Calculer le volume d'eau évaporé. n= 0,025 mol ; Cfinale =5,85 mol/L ; Cfinale =n/Vfinal ; Vfinal =n/Cfinale =0,025/5,85 =4,27 10-3 L. Volume d'eau évaporé
: 500-4,27 =495,7 mL ( 496 mL).
A 20°C on peut dissoudre au maximum 22 g de cafèine C8H10O2N4 par litre d'eau. On ajoute une masse m = 16,5 g de caféine à V mL d'eau. La solution n'est pas saturée. Calculer la valeur minimale de V. Vmini = 16,5 / 22 = 0,75 L Calculer la concentration molaire de la caféine. Masse molaire de la caféine : M =8*12 + 1*10 + 2*16 + 4*14= 194 g/mol. n = m/M = 16,5/194 = 8,5 10-2 mol ; [caféine]= n/V= 8,5 10-2 /0,75 = 0,11 mol/L.
Une masse m= 12,7 g de diiode (I2 : M= 254 g/mol) est ajoutée à V= 0,2 L de solution de diiode telle que [I2]0= 5,0 10-2 mol/L. Calculer la concentration molaire en diiode de la nouvelle solution. n (I2) dans la solution initiale : [I2]0 V = 0,05*0,2 =0,01 mol n (I2) ajouté = m/M = 12,7 / 254 = 0,05 mol n (I2) total = 0,06 mol dans V= 0,2 L d'où [I2]finale =0,06/0,2 = 0,30 mol/L On ajoute de l'eau distillée à cette dernière solution jusqu'à ce que la concentration redevienne égale à 0,05 mol/L. Calculer le volume d'eau ajouté. [I2]0
= n/V ; V= n/[I2]0 = 0,06/0,05
= 1,2 L ; on a donc ajouté 1 L d'eau.
On mélange un volume V = 0,25 L d'une solution contenant l'espèce A dissoute telle que [A]= 0,50 mol/L et V=0,25 L d'une solution obtenue en dissolvant m=24 g de A dans 0,25 L. Masse molaire de A : M=58 g/mol. Calculer la concentration de A dans le mélange. quantité de matière de A dans la solution 1 : n1 =[A] V = 0,5*0,25 =0,125 mol. quantité de matière de A dans la solution 2 : n2 =m/M = 24*58 =0,414 mol. n1 +n2 = 0,54
mol ; Vtotal = 0,5 L ; [A]final =
0,54/0,5 =1,1 mol/L.
L'étiquette d'un flacon indique densité d= 0,95 ; % massique en ammoniac : 28% ; V= 1 L ; M= 17 g/mol Caluler la concentration molaire de cette solution commerciale. masse de 1 L de solution : 950 g ; masse d'ammoniac pure : 950*0,28 = 266 g ; n(NH3) =266/17 = 15,6 mol dans 1L. Comment, à partir de la solution commerciale, préparer 1 L de solution diluée 100 fois ? Fiole jaugée de 1 L ; pipette jaugée de 10 mL + pipeteur. Prélever 10 L de la solution mère ( pipette jaugée) Placer dans la fiole jaugée de 1 L contenant un peu d'eau distillée. Compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher, agiter pour rendre homogène. |
|||||||||||||
|
|
|||||||||||||
|
|