|
tableau périodique ; quantité de matière ; réfrérentiel ; principe d'inertie. |
|||
|
|||
|
Soit l'élément chimique de numéro atomique Z= 12 : il s'agit du magnésium ; symbole Mg. Sa structure électronique est : K2L8M2. La couche M est partiellement remplie : Mg appartient donc à la 3ème ligne du tableau périodique. La dernière couche occupée, dans l'état fondamental, compte deux électrons : Mg appartient à la 2ème colonne. Le magnésium perd facilement ces deux électrons "externes" et donne l'ion Mg2+, dont la structure électronique externe est complète ( 8 électrons - règle de l'octet). La structure électronique d'un atome, dans son état fondamental, est K2L8M3 : Z = 2+8+3 = 13 , élément aluminium, symbole Al. La couche M est partiellement remplie : Al appartient donc à la 3ème ligne du tableau périodique. La dernière couche occupée, dans l'état fondamental, compte trois électrons : Al appartient à la 3ème colonne. L'aluminium perd facilement ces trois électrons "externes" et donne l'ion Al3+, dont la structure électronique externe est complète ( 8 électrons - règle de l'octet). Le gallium et le bore appartiennent à la même famille que l'aluminium. règle de l'octet : Soient 3 atomes notés A, B, C possédant respectivement 1, 6 et 2 électrons externes dans leur état fondamental. A et B appartiennent à la seconde ligne du tableau périodique : Structure électronique de A : K2L1 : Z= 3 , élément lithium Li. Structure électronique de B : K2L6 : Z= 2+6=8 , élément oxygène O. C appartient à la 3è ligne : Structure électronique de C : K2L8M2 : Z= 2+8+2=12 , élément magnésium Mg. Ions simples formés par ces éléments : La structure électronique externe ( dernière couche occupée dans l'état fondamentale des ions est complète : Li perd facilement un électron et donne : Li+ (K2); O gagne facilement 2 électrons et donne l'ion O2- ( K2L8) ; Mg perd facilement 2 électrons et donne l'ion
Mg2+(
K2L8).
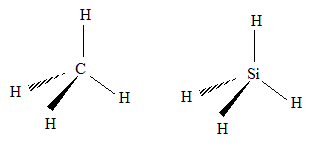
Z= 14 ; structure électronique dans l'état fondamental : K2L8M4. La couche M est partiellement remplie : Si appartient donc à la 3ème ligne du tableau périodique. La dernière couche occupée, dans l'état fondamental, compte 4 électrons : Si appartient à la 3ème colonne du tableau simplifié. Le carbone appartient également à cette colonne. Les structures de CH4 et SiH4 sont donc analogues :
calcium Ca ( Z= 20) : structure électronique K2L8M8 N2.. Ca perd facilement deux électrons et donne l'ion Ca2+ dont la couche électronique externe compte 8 électrons K2L8M8 ( règle de l'octet). fluor F ( Z= 9) : structure électronique K2L7. F gagne facilement un électron et donne l'ion F- dont la couche électronique externe compte 8 électrons K2L8 ( règle de l'octet). Un composé ionique constitué des ions Ca2+ et F- est électriquement neutre : d'où Ca2+ et 2 F- soit
encore CaF2.
Soit un comprimé de vitamine C ( C6H8O6 )de masse m = 0,5 g . On donne les masses atomiques molaires C : 12 ; H : 1; O : 16 g/mol. Masse molaire de la vitamine C : M =6*12 + 1*8 + 6*16 = 176 g/mol. quantité de matière d'acide ascorbique (mol) = masse (g) / masse molaire (g/mol) ou bien n = m/M = 0,5 / 176 = 2,84 10-3 mol. Dans une mole il y a NA = 6,02 1023 molécules ; dans 2,84 10-3 mol il y a : n*NA =2,84 10-3 * 6,02 1023 =1,7 1021 molécules. pourcentages molaires de chaque élément C, H, O dans l'acide ascorbique : nombre total d'éléments ; 6+8+6 = 20 % C = % O = 6/20*100 = 30 % ; % H = 8*100/20 = 40 % pourcentages massiques de chaque élément C, H, O dans l'acide ascorbique : masse de carbone dans une mole : 6*12 = 72 ; %C : 72/176*100 = 40,9 % masse d'oxygène dans une mole : 6*16 = 96 ; %O : 96/176*100 = 54,5 % masse d'hydrogène dans une mole : 8 ; %H :
8/176*100 = 4,6 %
Soit une boisson contenant m = 0,08 g de caféine. On donne les masses atomiques molaires C : 12 ; H : 1; O : 16 ; N : 14 g/mol. Masse molaire de la caféine : M =8*12 + 1*10 + 2*16 + 4*14= 194 g/mol. quantité de matière de caféine (mol) = masse (g) / masse molaire (g/mol) ou bien n = m/M = 0,08 / 194 = 4,12 10-4 mol. Dans une mole il y a NA = 6,02 1023 molécules ; dans 4,12 10-4 mol il y a : n*NA =4,12 10-4 * 6,02 1023 =2,48 1020 molécules. pourcentages massiques de chaque élément C, H, O, N dans la cafèine : masse de carbone dans une mole : 8*12 = 96 ; %C : 96/194*100 = 49,5 % masse d'oxygène dans une mole : 2*16 = 32 ; %O : 32/194*100 = 16,5 % masse d'hydrogène dans une mole : 10 ; %H : 10/194*100 = 5,2 % masse d'azote dans une mole : 4*14=56 ; %N : 56/194*100 = 28,9% Un paquet de 250 g de café moulu sans caféine contient au maximum 0,1 % de caféine en masse. La quantité de matière maximale de caféine est : masse maximale de caféine 250*0,1/100 = 0,25 g n= m/M = 0,25/194 = 1,29 10-3 mol de caféine.
La masse molaire atomique du lithium naturel est : 0,926 *7 + 0,074*6 = 6,482 + 0,444
= 6,93 g/mol.
Dans le référentiel héliocentrique, la terre se déplace autour du soleil sur une orbite quasi-circulaire de rayon R= 1,5 1011 m. La terre effectue un tour en T= 365,25 jours La vitesse du centre de la terre est : v (m/s) = distance (m) / durée (s) La distance est la circonférence du cercle de rayon R : d = 2pR = 2*3,14*1,5 1011 = 9,42 1011 m. durée T = 365,25 *24*3600 =3,156 107 s. vitesse v = 9,42 1011 /
3,156 107 = 2,98 104 m/s.
Sur la roue d'une voiture on effectue deux marques à la peinture : une marque bleue sur le pneu et une marque rouge au centre de la roue. La voiture se déplace en ligne droite et à vitesse constante. Dans un référentiel lié à la voiture ( pour un observateur ou une caméra situé dans la voiture) : la marque bleue décrit un cercle ; la tache rouge paraît immobile. Dans un référentiel lié à la route, réfrérentiel terrestre ( pour un observateur ou une caméra situé sur le bord de la route) : la marque bleue décrit une cycloïde, combinaison d'un mouvement circulaire et d'un mouvement rectiligne ; la tache rouge décrit une ligne horizontale.
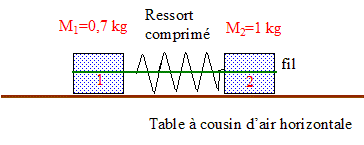
Le fil casse; les deux solides se séparent et décrivent des trajectoires rectilignes.
La durée séparant deux inscriptions ( points) consécutives est t = 60 ms = 0,06 s. Le référentiel d'étude est la table à coussin d'air. Les distances parcourues par le centre d'inertie de chaque solide pendant les durées t sont constantes : le mouvement est donc uniforme ; de plus il est rectiligne. D'après le principe d'inertie ( 1ère loi de Newton), chaque solide est pseudo-isolé. Les forces qui agissent sur chaque solide se neutralisent.
vitesse v1 = 0,01/0,06 =0,17 m/s ; v2 = 0,007/0,06 =0,116 m/s ( 0,12 m/s). rapport des vitesses : v1 /v2 =0,01/0,007 =10/7 =1,4 Or M2/M1 = 1/0,7 =1,4. La vitesse est inversement
proportionnelle à la masse. M1
v1= M2v2
|
|||
|
|
|||
|
|