|
Stockage du dihydrogène : loi des gaz parfaits ; électrolyse de l'eau ; énergie, puissance , rendement concours général physique 2007 |
|||||||
|
|||||||
|
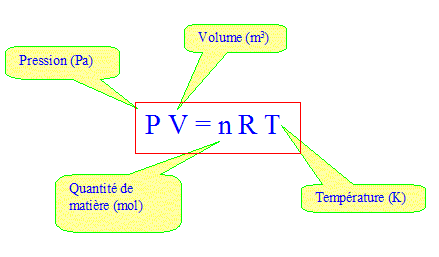
Le dihydrogène peut être stocké à bord du véhicule sous forme liquide à la température de 20 K ( soit -253 °C) ou piègé dans un matériau solide ( à base d'hydrure métallique) On envisage ici de le stocké sous forme gazeuse à haute pression dans un réservoir composite. Dans cette partie le dihydrogène sera assimilé à un gaz parfait. On donne R= 8,31 J K-1 mol-1, constante des gaz parfaits. On souhaite stocker une masse m = 5,0 kg de dihydrogène gazeux. Stocké sous la ression atmosphérique P0= 1,0 105 Pa à la température ambiante T0= 293 K, le volume V serait : Quantité de matière (mol) = masse (g) / masse molaire ( g/mol) avec MH2 = 2,0 g/mol et m = 5000 g n = m/M=5000/2 = 2500 mol
V= nRT/P = 2500*8,31*293 / 105 =61 m3. Le dihydrogène gazeux est en fait placé dans un réservoir de volume V= 150 L à la température ambiante. Pression à l'intérieur de l'enceinte : P= nRT/V avec V= 0,15 m3. P= 2500*8,31*293 / 0,15 = 4,1 107 Pa = 4,1 102 bar. (405,8 ) ( 410 fois la pression atmosphérique). Remarque : dans ces conditions de pression le gaz ne peut pas être considéré comme parfait. pression de rupture : Le constructeur précise que le réservoir a une pression de rupture Prupt égale à 2,35 fois la pression de service. Prupt = 2,35*4,058 102 =9,5 102 bar. ( 953,6) Température Trup à partir de laquelle la pression du gaz devient comparable à Prupt : Trupt = Prupt V / (nR) =9,536 107*0,15 / (2500*8,31) =688 K. ( 961 °C) Cette température peut être atteinte lors d'un incendie. Dans la réalité des soupapes de sécurité libèrent d'autant plus rapidement le gaz dans l'atmosphère que celui-ci est plus léger, en cas de surpression accidentelle.
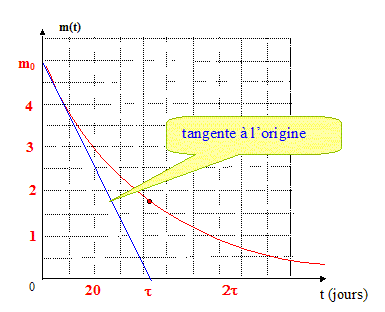
Attention aux fuites ! Les fuites sont inévitables, la molécule H2 étant la plus petite qui existe. Les constructeurs impose un taux de fuite de dihydrogène maximal de 1,0 g de H2 par kg de H2 stocké et par heure. Expression du taux de fuite , noté a, en s-1 : 1,0 10-3 kg perdu par kg en stock en 3600 s soit a= 10-3 / 3600 = 2,8 10-7 s-1 ( 2,777 ) Variation de masse du réservoir : Entre les instants très proches dt et t+dt, la masse du réservoir diminue d'une quantité très petite notée dm : On note m(t) la masse de dihydrogène contenue dans le résevoir à la date t. A chaque seconde la masse de H2 diminue de -a m kg ( le signe moins traduit le mot "diminue" ) soit en dt seconde une diminution de : dm = - -a m(t) dt. Equation différentielle du premier ordre vérifiée par m(t) : dm/dt = - a m(t) soit dm/dt + a m(t) =0 (1) Montrons que m(t) = m0 exp(-t/t) est solution de cette équation : dm/dt = -m0/t exp(-t/t) ; repport dans (1) : -m0/t exp(-t/t) + am0exp(-t/t) = 0 Cette égalité est vérifiée quel que soit le temps si : t = 1/a. t = 1/ 2,777 10-7 = 3,6 106 s = 42 jours. t est le temps de fuite caractéristique du réservoir ; au bout de 5 t voisin de 200 jours, le réservoir est vide du fait des fuites. Allure de la courbe m(t) :
De l'énergie apportée sous forme électrique ( électrolyse) permet la dissociation de la molécule d'eau delon la réaction : H2O --> H2 + ½O2. masse d'eau nécessaire à la production de 5,0 kg de dihydrogène : nH2 = m/MH2 = 5000 / 2 = 2500 moles. nH2 = nH2O =2500 moles meau = nH2O*MH2O =2500*18 = 4,5 104 g = 45 kg ou encore un volume de 45 dm3 = 45 L d'eau. Energie électrique à fournir : La dissociation d'une mole d'eau en dihydrogène et dioxygène nécessite 241 kJ W= 2500*241 = 6,0 105 kJ. ( 6,025 ) or 1 kilovattheure = 1kWh = 3600 kJ d'où W = 6,025 106 / 3600 = 1,7 102 kWh ( 1,674 ) Un particulier désire produire ce dihydrogène à la maison . Sa puissance électrique est P= 10 kW. La durée de production serait voisine de 1,7 102 / 10 = 17 heures. Le kWh étant facturé 0,054 euros TTC en heures creuses, cette production coûterait environ : 1,7 102 * 0,054 = 9,2 euros. Panneaux solaires : On envisage la production de cette énergie électrique en utilisant des panneaux solaires dont le rendement est de 20 %. ( 20 % de l'énergie lumineuse reçue est convertie en énergie électrique). L'énergie solaire reçue par la terre est de l'ordre de 1,0 kW m-2. Calculons la surface S des panneaux solaires utiles à la production d'une puissance de 10 kW. puissance solaire = puissance électrique / 0,20 = 10 / 0,20 = 50 kW. surface de ces panneaux S = 50 / 1,0 = 50 m2. En supposant que la durée moyenne d'ensoleillement sous nos latitudes est en moyenne de 2 heures par jours, la durée nécessaire pour produire 170 kWh serait de 170/10 = 17 heures soit environ 9 jours.
On considère un véhicule doté d'un réservoir de m = 5,0 kg de dihydrogène. L'autonomie d'un tel véhicule doit être comparable à celle d'un véhicule traditionnel. Energie totale susceptible d'être libérée par la pile : L'énergie libérée par la synthèse d'une mole d'eau est de -241 kJ 5,0 kg de dihydrogène correspond à 2500 moles de H2. L'énergie
libérée est alors voisine de : 2500 * 241 =
6,0 105
kJ.
En fait les prototypes des piles à combustible actuelles ont un rendement de 50 % : la moitié de l'énergie libérée par la synthèse de l'eau est convertie en énergie électrique, le reste étant dissipé sous forme thermique. 6,0 105 *0,5
= 3,0 105
kJ.
Un moteur électrique convertit alors l'énergie électrique dsiponible en énergie mécanique utile avec un rendement de 65 %. 3,0 105 * 0,65 = 2,0 105 kJ.
Durée maximale d'un trajet effectué : puissance ( kW) * durée ( heure )= énergie (kWh) 2,0 105 kJ = 2,0 105 / 3600 = 55,5 kWh durée = 55,5 / 12 = 4,6 heures. Distance maximale parcourue par le véhicule : 110 *4,6 = 510 km.
|
|||||||
|
|
|||||||
|
|