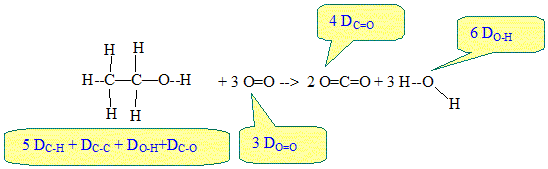|
Ethanol : biocarburant ; classes d'alcools ; oxydation ; combustion ; pouvoir calorifique concours général physique 2007 |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
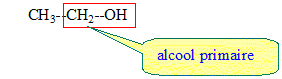
L'éthanol est un alcool primaire issu de la culture de betteraves ou de blé après fermentation des sucres.
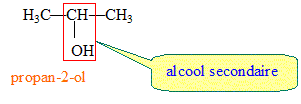
Exemple d'un alcool secondaire :
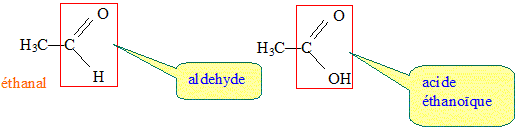
Par oxydation ménagée l'éthanol conduit à l'éthanal, puis à l'acide éthanoïque, présent dans le vinaigre.
Combustion de l'éthanol dans le dioxygène de l'air La combustion complète donne de l'eau et du dioxyde de carbone. C2H6O + 3O2 = 2CO2 + 3H2O. La combustion incomplète ( oxygène en défaut) donne de l'eau, du monoxyde de carbone et des particules noires de carbone. C2H6O + 2O2 = 2CO + 3H2O. Le monoxyde de carbone, gaz incolore et inodore est toxique : il bloque les échanges de dioxygène au niveau des poumons avec le sang. ( il bloque les échanges de dioxygène avec l'hémoglobine en se fixant dessus sans pouvoir être libéré) Ce qui n'est pas le cas pour CO2 (aussi inodore et incolore) mais qui peut être libéré lui.
Energie libérée par cette réaction de combustion : Soit une molécule contenant des liaisons A--B entre les atomes A et B. Par définition l'énergie de liaison DA-B est l'énergie qu'il faut fournir pour dissocier une mole de liaisons A--B et ainsi séparer les atomes A et B à l'état gazeux. C'est également l'énergie libérée lors de la formation d'une mole de liaison A-B à partir des atomes A et B pris séparément à l'état gazeux.
q1 = 5DC-H + DC-C + DC-O + DO-H = 5*410+348+356+460 = 3,21 103 kJ/mol. Energie q libérée par la combustion complète d'une mole d'éthanol ( pouvoir calorifique ) : q = [ 5DC-H + DC-C + DC-O + DO-H + 3DO=O] - [ 4DC=O +6DO-H q=[ 5*410+348+356+460 + 3*494 ] -[4*795 +6*460] q= 4696 -5940= -1,24 103 kJ/mol. q est négatif : de l'énergie est libérée vers l'extérieur ; la combustion est exothermique.
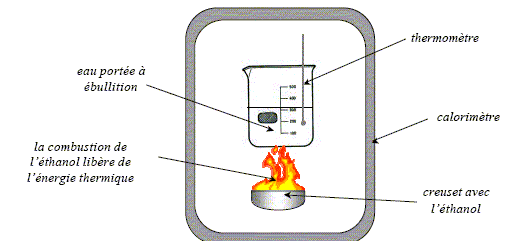
On considère l'expérience suivante qui consiste à brûler une masse m= 5,0 g d'éthanol. l'énergie libérée par la combustion permet de chauffer une masse Mi=50 g d'eau placée dans un bécher, de la température ambiante q0 = 20 °C à la température d'ébullition de l'eau q éb = 100°C sous la pression atmosphérique. L'eau bout et s'échappe en partie sous forme de vapeur. Une fois que tout l'éthanol à brûlé, on mesure la masse Mf =42 g d'eau qui reste dans le bécher. On réalise l'expérience dans un calorimètre, c'est à dire que l'on néglige dans un premier temps toute perte d'énergie vers l'extérieur. Capacité thermique massique de l'eau : ceau = 4,18 kJ kg-1 K-1 ; capacité thermique du calorimètre : C= 1,20 kJ K-1 ; chaleur massique de vaporisation de l'eau : Lv= 2,25 103 kJ kg-1 ( à 100 °C)
Energie thermique Q1 nécessaire pour augmenter la température de l'eau et du calorimètre : Q1 = Mi ceau (q éb -q 0 ) + C(q éb -q 0 ) = ( Mi ceau+C)(q éb -q 0 ) Q1 = (0,05 * 4,18 +1,2) (100-20) = 1,1 102 kJ ( 112,7 ) . Energie thermique Q2 nécessaire pour vaporiser l'eau à 100°C : Q1 =( Mi - Mf ) Lv= 8 10-3 * 2,25 103 =18 kJ ( 17,6 ) Pouvoir calorifique de
l'éthanol : q =
112,7 + 17,6 = 1,3
102 kJ (130,3 ).
Le tableau suivant rassemble le
pouvoir calorifique massique moyen de quelques combustibles
courants : La combustion de 5,0 g libère 1,3 102 kJ qm = 1,3 102 / 5,0 10-3 = 26 103 kJ kg-1. Du même ordre de grandeur que celui du charbon, 1,5 fois plus faible que celui de l'essence. Le CO2 rejeté par la combustion de l'éthanol, contribue très peu à l'effet de serre : en effet, lors de sa croissance, la plante a absorbé une certaine quantité de dioxyde de carbone. |
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||
|
|