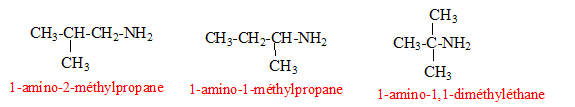|
structure d'une amine : dosage acide base |
|||
|
|||
|
On dose un volume V1=40 cm3de cette solution par de l'acide chlorhydrique de concentration C2 =0,2 mol/L. Le virage de l'indicateur coloré se produit quand on a versé un volume V2= 20,5 cm3 d'acide. En déduire la masse molaire de l'amine A et sa formule brute. L'amine est une base notée B. couples acide base en présence : BH+ / B et H3O+/H2O. Réaction du dosage : H3O+ + B = BH+ + H2O A l'équivalence les quantités de matière d'acide chlorhydrique et d'amine sont en proportions stoechiométriques. n( B) = C2V2= 0,2*20,5 10-3 = 4,1 10-3 mol. Concentration de l'amine (mol/L) = quantité de matière (mol) / volume de la prise (L) [B]= 4,1 10-3 / 40 10-3 = 0,1025 mol/L concentration (mol/L) * masse molaire ( g/mol) = titre massique ( g/L). masse molaire ( g/mol) = 7,5 / 0,1025 = 73 g/mol. Formule brute : CxHyN 12x+y +14 = 73 ; 12x+y = 59 soit x = 4 et y=11 C4H11N.
Quelles sont les formules sémi-développées possibles de A ? L'amine A est primaire : R-NH2. avec R = C4H9- CH3-CH2-CH2-CH2-NH2 : butylamine, 1-aminobutane
Montrer que sa formule
semi- dévéloppée peut
être déterminée sans
ambiguité.
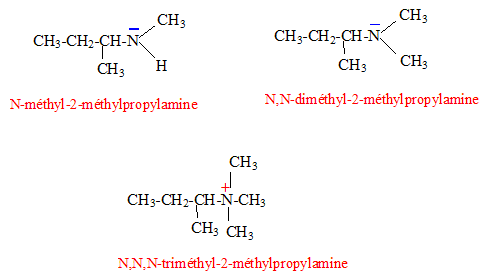
L'ion ammonium quartenaire présente-t-il des propriétés nucléophiles ? Les propriétés nucléophiles des amines sont dues à la présence du doublet porté par l'atome d'azote. L'atome d'azote de l'ion ammonium quaternaire ne porte plus de doublet : ce dernier ne possède aucune propriété nucléophile.
|
|||
|
|
|||
|
|