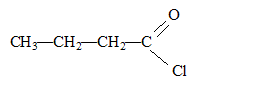|
concours d'entrée médecine dentaire chimie organique, acide base, oxydo-réduction Rabat 2006 |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
- La vitesse de disparition d'un réactif est indépendante de la vitesse de formation d'un produit. Faux. L'un des produits peut servir de catalyseur ( autocatalyse) et modifier la vitesse de la réaction. - La vitesse de formation d'un produit est toujours positive. Vrai. - La saponification d'un ester est une réaction limitée et lente. Faux. La saponification est totale. - La déshydratation intramoléculaire d'un alcool donne un alcène. Vrai. - La réaction d'un alcool avec un métal sodium est une réaction d'oxydo-réduction. Vrai. Formation d'un alcoolate de sodium et dégagement d'hydrogène. Couple oxydant réducteur Na+/Na et Alcool / H2.
On dilue 10 fois une solution aqueuse d'un monoacide fort, la valeur de son pH augmente de : 1 ; 0,1 ; 2 ; 10. La concentration des ions H3O+ est divisée par 10 et log 10 = 1. A 20 mL d'un monoacide fort de concentration molaire 0,01 mol/L, on ajoute 10 mL d'une mlonobase forte de concentration 0,02 mol/L. La valeur du pH obtenue est : 2 ; 2,3 ; 7 ; 12. Quantité de matière (mol) = volume (L) * concentration (mol/L) n(acide) = 0,02*0,01 = 2 10-4 mol. n(base) = 0,01*0,02 = 2 10-4 mol On se trouve à l'équivalence d'un dosage acide fort base forte : le pH vaut 7. A l'instant t=0, on fait réagir 0,05 mol da magnésium avec 0,2 mol d'acide chlorhydrique. Ecrire l'équation de la réaction d'oxydo-réduction qui a lieu. ( couples oxydant réducteur Mg2+/Mg et H+ /H2) Mg + 2H+ = Mg2++H2. Quel est le réactif limitant ? Justifier. 1 mol de magnésium réagit avec 2 mol d'ion H+. 0,05 mol de magnésium réagit avec 0,1 mol d'ion H+ : or il y a 0,2 mol d'ion H+ initialement ; l'acide est donc en ecxès de 0,1 mol. Le magnésium constitue le réactif limitant. Calculer la vitesse volumique moyenne de formation des ions Mg2+ entre les instants t½ = 20 s ( temps de demi-réaction) et tf=70 s ( temps de fin de réaction). On donne V= 1 L. L'avancement final est xf = 0,05 mol ; à t½ l'avancement est égal à la moitié de l'avancement final soit xt½ =0,025 mol. Dx = xf -xt½ =0,025 mol. D t = 70-20 = 50 s. vitesse volumique moyenne =1/V Dx / D t = 2,5 10-2 / 50 = 5 10-4 mol s-1 L-1.
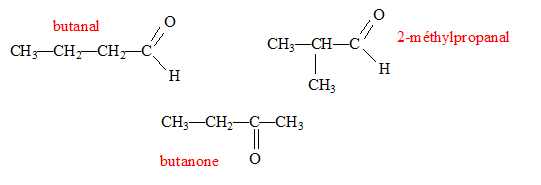
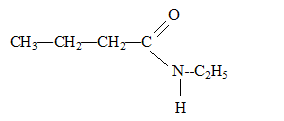
Un composé organique A non cyclique, à chaine carbonée saturée a pour formule brute C4H8O. Ecrire les formules semi-développées possibles pour A. Nommer les composés. Le composé A réagit avec la DNPH et la liqueur de Fehling. En déduire le composé A sachant que sa chaîne carbonée est linéaire. Le test positif à la DNPH indique un groupe carbonyle >C=O ; le test positif à la liqueur de Fehling indique un aldehyde. Butanal. Dans les trois équations suivantes, identifier et nommer les composés organiques B, D et E, puis compléter les équations. ... A + Cr2O72- + ... H3O+ = ... B + ... Cr3+ + 12 H2O. B est l'acide butanoïque CH3-CH2-CH2-COOH ( C4H8O2) 3C4H8O+ Cr2O72- + 8 H3O+ = 3 C4H8O2+ 2 Cr3+ + 12 H2O. B + PCl5 = D +.... +.... D est le chlorure de butanoyle CH3-CH2-CH2-COOH + PCl5 = CH3-CH2-CH2-COCl + POCl3 + HCl. D+ 2 C2H5-NH2 = E + ... E est un amide secondaire CH3-CH2-CH2-COCl+ 2 C2H5-NH2 = CH3-CH2-CH2-CO -NH-C2H5 + C2H5-NH3++Cl-.
L'étiquette d'une solution commerciale S0 d'un vinaigre porte l'indication ' vinaigre 7° " ce qui correspond à 70 g d'acide éthanoïque par litre de vinaigre. On dilue 10 fois S0, on obtient une solution S1. On dose un volume V1 = 10 mL de solution S1 par une solution aqueuse S2 d'hydroxyde de sodium de concentration molaire c2 = 0,1 mol/L. Le tableau suivant donne le pH du mélange en fonction du volume V2 de solution S2 versée.
CH3-COOH + HO- = CH3-COO- + H2O. Déterminer la valeur du pH de la solution S1 et du pKa du couple acide éthanoïque / ion éthanoate. Le pH initial est le pH de la solution S1 : 3,35. A la demi-équivalence ( V2 =5,8 mL) le pH est égal au pKa : 4,60. Calculer la valeur de la concentration molaire C1 de la solution S1. A l'équivalence V1C1 = V2E C2 soit C1 =V2E C2 /V1 = 11,6*0,1/10 = 0,116 mol/L. L'indication portée par la bouteille est-elle exacte ? M( acide éthanoïque ) = 60 g/mol. masse d'acide dans un litre (g) = concentration ( mol/L) * masse molaire (g/mol) 0,116*60 = 69,6 g/L. L'indication est donc exacte. |
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|