|
concours d'entrée médecine chimie organique ; acide méthanoïque . Casablanca 2006 |
|||
|
|||
|
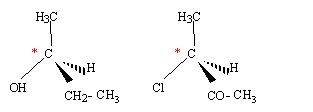
Quelle molécule présente un carbone asymétrique ? Un carbone asymétrique est un carbone lié à quatre substituants (ou groupes) différents. Donc molécules C ( carbone n°2 )et D ( carbone n°3 ).
Quelle molécule présente une isomérie Z E ?
Quelle molécule en s'oxydant conduit à un acide carboxylique ? Un alcool primaire (-CH2OH ) conduit par oxydation ménagée à un acide carboxylique. molécule
B.
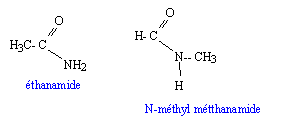
C: 12 ; N : 14 ; O : 16 ; H : 1 g/mol. Calculer n : 12 n+2n+1+16+14 = 59 ; n = 2. Ecrire la formule semi-développée de chaque isomère de cet amide et nommer les.
La réaction du chlorure d'acyle (C) avec l'ammoniac conduit à l'un des isomères de cet amide. Ecrire l'équation de la réaction et nommer le composé C. CH3-COCl + 2NH3 = CH3-CO NH2 + NH4+ + Cl-. CH3-COCl : chlorure d'éthanoyle On obtient le composé C et d'autres produits à partir d'une réaction entre un composé organique D et le chlorure de thionyle SOCl2. Ecrire l'équation de la réaction et donner le nom du composé D. CH3-COOH +SOCl2 = CH3-COCl + HCl + SO2. CH3-COOH : acide éthanoïque ( acétique).
Toutes les solutions sont à 25 °C. Soit une solution SA d'acide méthanoïque H2CO2, de concentration CA= 0,1 mol/L et de pH = 2,5. Démontrer que cet acide est un acide faible. Dans l'hypothèse d'un acide fort : pH= - log CA= -log 0,1 = 1 Or le pH mesuré est supérieur à 1 : l'acide est un acide faible. Ecrire son équation de la réaction avec l'eau. H2CO2 + H2O = HCO2- + H3O+. Citer les entités chimiques présentes dans la solution et donner leur concentration ( sauf l'eau). acide méthanoïque, ion méthanoate, ion oxonium ( l'ion hydroxyde est minoritaire) La solution reste électriquement neutre : [ HCO2- ]=[ H3O+]=10-pH =10-2,5 = 3,2 10-3 mol/L. Conservation de l'élément carbone : [H2CO2]+ [ HCO2- ] =CA = 0,1. [H2CO2] = 0,1-3,2 10-3 = 9,7 10-2 mol/L. En déduire le pKa de HCOOH/HCOO-. pH= pKa + log ([ HCO2- ] /[H2CO2]) pKa =pH- log ([ HCO2- ] /[H2CO2]) =2,5-log(3,2 10-3 / 9,7 10-2) =4,0. Calculer le coefficient de dissociation a de cet acide. a =[ HCO2- ]/ CA =3,2 10-3 / 0,1 = 3,2 10-2.
|
|||
|
|

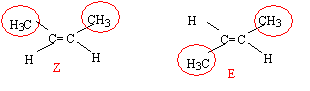 molécule
A.
molécule
A.