|
concours d'entrée médecine chimie : alcools, estérification, oxydation ménagée. Casablanca 2005 |
|||
|
|||
|
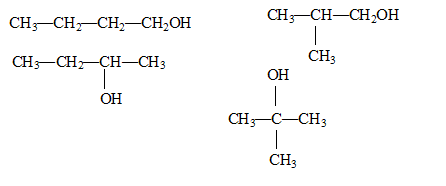
CH3-CH2-CH2-CH2OH : butan-1-ol. CH3-CH2-CH(OH)-CH3 : butan-2-ol. (CH3)2CH-CH2OH : 2-méthylpropan-1-ol (CH3)3C-OH : 2-méthylpropan-2-ol
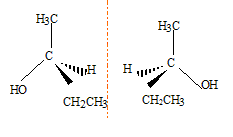
L'une des molécule présente une isomérie optique. Laquelle ? Justifier. Le butan-2-ol possède un atome de carbone asymétrique : carbone tétragonal relié à 4 substituants ou groupes différents. En conséquence cette molécule présente une isomérie optique. Représenter les énantiomères de cette molécule.
La réaction du permanganate de potassium KMnO4 en milieu acide avec l'un des alcool conduit à un composé cétonique. Donner le nom de cet alcool et écrire la réaction correspondante. Un alcool secondaire conduit par oxydation ménagée à une cétone : butan-2-ol ---> butanone 2 fois { MnO4- + 8H++5 e- = Mn2+ + 4H2O } réduction 5 fois { CH3-CH2-CH(OH)-CH3 = CH3-CH2-CO-CH3 + 2H+ + 2 e- } oxydation. 2MnO4- + 5CH3-CH2-CH(OH)-CH3 + 6H+ =5 CH3-CH2-CO-CH3 +2 Mn2+ +8H2O
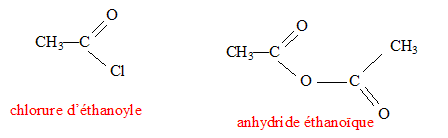
On considère l'alcool A dont la masse molaire est égale à 46 g/mol. Donner la formule brute de A. Formule générale d'un alcool CnH2n+2O ; M= 12n+2n+2+16 = 46 ; n = 2 C2H6O éthanol. L'alcool A réagit avec l'acide éthanoïque CH3-COOH pour donner un produit E et de l'eau. Donner l'équation bilan de la réaction et nommer E. estérification : CH3-COOH+ CH3-CH2OH = CH3-COO-CH2-CH3 + H2O L'ester est l'éthanoate d'éthyle. Deux autres réactifs C ou D peuvent réagir avec A pour obtenir le même produit E. Donner les formules semi-développées de ces réactifs.
Sachant que la réaction du réactif C avec l'alcool A, se fait par une réaction rapide et totale, donne un gaz plus le produit E. Donner lm'équation bilan de cette réaction. CH3-COCl + CH3-CH2OH ---> CH3-COO-CH2-CH3 + HCl Pour doser l'alcool dans le sang d'un être humain, on prend 10 mL de sang, on extrait l'alcool éthylique. On dose la solution d'alcool extraite par une solution de dichromate de potassium K2Cr2O7 de concentration c= 0,02 mol/L, en milieu acide. L'équivalence est obtenue pour V=10 mL dee dichromate de potassium. Quel est le rôle du dichromate de potassium ? Oxydant ; l'alcool joue le rôle de réducteur. Ecrire l'équation bilan de la réaction. 2 fois { Cr2O72- + 14 H+ + 6 e- = 2 Cr3++7 H2O } 3 fois { CH3-CH2OH +H2O = CH3-COOH + 4e- + 4H+} 2 Cr2O72- + 16 H+ + 3 CH3-CH2OH = 4 Cr3++ 11H2O + 3 CH3-COOH Calculer en g/L la concentration d'alcool dans le sang. n( éthanol) = 1,5 n( dichromate) ; n( dichromate)= CV = 0,02*10 = 0,2 mmol n( éthanol) =1,5*0,2 = 0,3 mmol dans 10 mL de sang soit 30 mmol /L ou 0,03 mol/L Masse molaire éthanol : M= 2*12+6+16 = 46 g/mol masse d'éthanol (g) = quantité de matière (mol) * masse molaire (g/mol) m = 0,03*46 = 1,38 g/L.
|
|||
|
|