|
concours d'entrée médecine chimie organique : conformation et configuration ; aspirine . Casablanca 2004 |
|||
|
|||
|
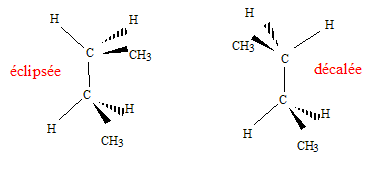
Donner le nom de chaque composé. éthane, ( Z) ou (E) pent-2-ène acide 2-hydroxypropanoïque, propanone ( acétone). Donner dans l'espace les isomères de conformation de A1.
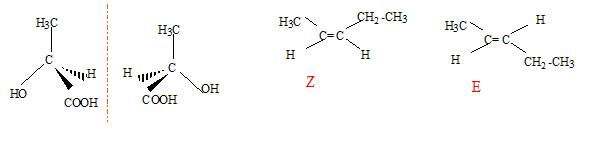
Parmi les 4 composés cités, deux présentent des isomères de configuration. Préciser pour chacun d'eux le type d'isomèrie. A2 : diastéréoisomères ( type Z ou E) ; A3 ; énantiomères. Donner les représentations dans l'espace de chaque stéréoisomères pour chacun des deux composés.
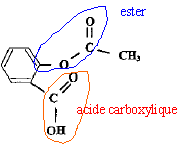
L'aspirine est un composé organique dont la
formule développée est Quelles sont les fonctions présentes dans cette molécule ?
On dissout un comprimé d'aspirine dans 250 mL d'eau. La solution SA obtenue a un pH de 2,8. Est-elle acide ou basique ? A 25°C si le pH est inférieur à 7, le milieu est acide. Laquelle des solutions titrantes suivantes
(ST) doit-on choisir pour doser cette
solution ? On prélève 10 mL de la solution SA que l'on dose par la solution titrante ST de concentration CT= 0,01 mol/L. Soit Véq = 11,2 mL le volume versé à l'équivalence. Ecrire l'équation de la réaction. C9H8O4 + HO- --> C9H7O4- + H2O Calculer la concentration molaire de la solution A. A l'équivalence les quantités d'acide et de base mis en présence sont dans les proportions stoéchiomètriques CaVa = CTVéq Ca =CTVéq / Va = 0,01*11,2 /10 = 1,12 10-2 mol/L. soit 1,12 10-2 *0,25 = 2,8 10-3 mol dans 250 mL En déduire la masse d'aspirine contenue dans le comprimé. masse (g)= quantité de matière (mol) * masse molaire (g/mol) m= 2,810-3 *180 = 0,50 g.
|
|||
|
|
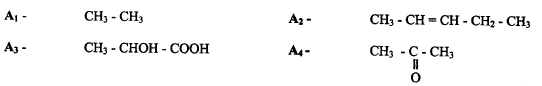
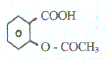 Sa masse molaire est M= 180 g/mol
Sa masse molaire est M= 180 g/mol