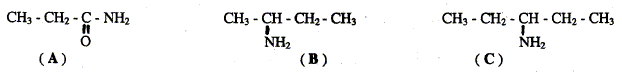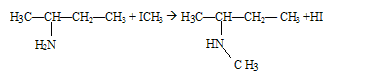|
concours d'entrée médecine chimie organique, acide base. Casablanca 2003 |
|||
|
|||
|
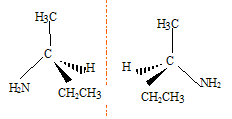
Laquelle présente une isomérie optique ? B B possède un atome de carbone asymétrique : carbone lié à 4 groupes différents. Représenter les deux énantiomères de cette molécule :
Quelle est la fonction chimique présente dans la molécule A ? Le groupe d'atomes -CO-NH2 correspond à la fonction amide. L'action du iodure de méthyle ICH3 sur la molécule B donne le produit de réaction D. Ecrire l'équation bilan ce la réaction :
Donner le nom du produit D. N,N-diméthylpropylamine.
A : HCl B : CH3COOH, pK1=4,70, K1 = 2,0 10-5. C : HCOOH, pK2=3,75, K2 = 1,8 10-4. On mélange des volumes égaux, notés V, de A et B. Calculer le pH de la solution D obtenue. Quantité de matière d'ion oxonium H3O+ : solution A : nA= V C=V mol solution B : [H3O+ ] = (C K1)½ =( 2,0 10-5)½ . D'où nB=( 2,0 10-5)½ V mol ntotal = nA+ nB ; [H3O+ ]total = (nA+ nB) / (2V) = 0,5( 1+( 2,0 10-5)½ ) voisin de 0,5 mol/L pH= -log[H3O+ ]total = -log 0,5= log2 ; pH= 0,3. On mélange des volumes égaux, noté V, de B et C. Calculer le pH de la solution E obtenue. Quantité de matière d'ion oxonium H3O+ : solution C : nC= [H3O+ ] = (C K2)½ =( 1,8 10-4)½ . D'où nB=( 1,8 10-4 )½ V= 1,34 10-2V mol solution B : [H3O+ ] = (C K1)½ =( 2,0 10-5)½ . D'où nB=( 2,0 10-5)½ V = 4,5 10-3 V mol ntotal = nC+ nB ; [H3O+ ]total = (nC+ nB) / (2V) = 0,5(1,34 10-2 + 4,5 10-3) voisin de 9 10-3 mol/L pH= -log[H3O+ ]total = -log 9 10-3= log2 ; pH= 2.
On dissout un volume V de chlorure d'hydrogène dans de l'eau distillée. On obtient une solution aqueuse SA de HCl de volume VA= 0,5 L et de concentration CA=0,25 mol/L. On donne Vm= 24 L/mol. La température est 25°C. Ke = 10-14. Calculer le volume V. n(HCl)= n(H3O+ ) = VACA=0,5*0,25 = 0,125 mol. Volume du gaz (L) = quantité de matière (mol) * volume molaire des gaz ( L/mol) V= 0,125*24 = 24/8 = 3 L. On prend un volume VA1 de la solution SA, on ajoute VE=120 mL d'eau distillée, on obtient une solution diluée S'A de pH=2. Sachant que l'acide chlorhydrique est un acide fort, donner la concentration C'A de la solution S'A et en déduire le volume VA1 . pH=-log C'A ; C'A = 10-pH = 0,01 mol/L. n(H3O+) =C'A (VA1 +VE) = 0,01(VA1 +0,12) d'autre part n(H3O+) =CA VA1 =0,25VA1. D'où : 0,01(VA1 +0,12) = 0,25VA1. VA1=0,12/24 = 0,05L = 5 mL. On dose un volume VB=20 mL d'une solution aqueuse d'ammoniac de concentration CB par la solution SA d'acide chlorhydrique de concentration CA= 0,25 mol/L. Le point d'équivalence est atteint à un pH=5,8 lorsqu'on a versé un volume VA=16 mL de la solution SA. NH3 est une base faible : le pH du point équivalent est différent de 7. Equation bilan de la réaction. NH3 + H3O+ = NH4+ + H2O Calculer CB. A l'équivalence : VBCB =CAVA; CB =CAVA/VB =0,25*16/20 = 0,25*4/5 = 0,2 mol/L.
|
|||
|
|