|
Thermodynamique : gaz parfait , entropie, énergie interne concours ITPE ( travaux publics) interne 2004 |
|||
|
|||
|
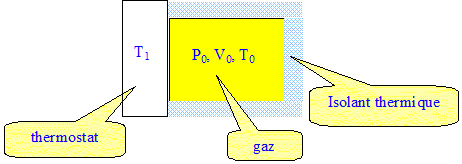
On considère un récipient de volume fixe contenant un gaz parfait dans les conditions initiales P0, V0, T0. La transformation consiste à mettre une des parois du récipient en contact avec une source thermique de température fixée T1, les autres parois restent calorifugées. A.N : P0=1 bar ; T0 = 300 K ; V0 = 10 L ; T1 = 350 K ; R= 8,32 J K-1 mol-1. Etat initial :
Comment peut-on qualifier la transformation ? Le volume du récipient reste constant : la transformation est isochore. Le réchauffement du gaz est une transformation monotherme ( le gaz n'échange de la chaleur qu'avec une seule source). Etat final, à l'équilibre :
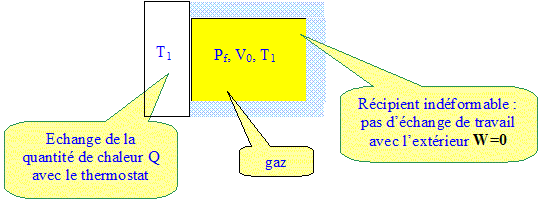
La loi des gaz parfait conduit à : dans l'état initial : P0V0 = nR T0 dans l'état final : PfV0 = nR T1 soit : Pf =P0 T1 /T0 . Pf = 1*350/300
=1,17
bar.
La variation d'énergie interne d'un gaz ne dépend que de la température. DU = cv D T = cv ( T1-T0) avec cv : capacité thermique à volume constant : cv=nR/(g-1) n = P0V0/(RT0) avec P0 = 105 Pa et V0 = 10-2 m3. n = 105 10-2 / (8,32*300) = 0,40 mol cv = 0,40*8,32 / (1,4-1) = 8,32 J K-1. DU = 8,32 (350-300) ; DU = 416 J.
DH= cP D T = cP ( T1-T0) avec cp : capacité thermique à pression constante : cp=gcv DH=gcv( T1-T0) = gDU=1,4 *416 ; DH= 582 J. Variation de l'entropie du gaz : D S = cv ln (T1/T0) pour une transformation isochore. DS=8,32 ln(350/300) ; DS= 1,28 J K-1. Chaleur échangée au cours de la transformation : Le travail des forces de pression est nul ( le récipient est indéformable). Or DU = W + Q d'où Q = DU = 416 J. Entropie échangée au cours de la transformation : Séch = Q/T1 = 416/350= 1,19 J K-1. Entropie créée au cours de la transformation : La variation d'entropie correspond à une entropie d'échange Séch et à une entropie Scréée créée par l'irréversibilité. Séch +Scréée = DS Scréée = DS - Séch = 1,28-1,19 = +0,09 J K-1.
|
|||
|
|
|||
|
|