|
concours assistant ingénieur chimiste, sciences des matériaux partie B, 2006 |
|||||||
|
|||||||
|
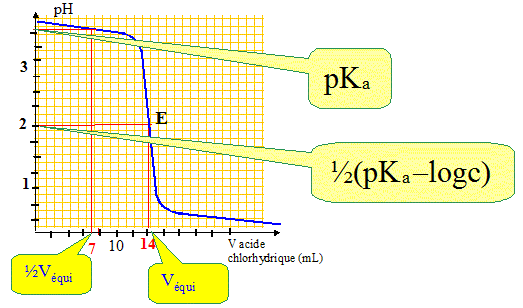
Donner l'expression et la valeur du potentiel de Nernst à 20 °C pour une solution à l'équilibre de Fe3+ 0,025 M et Fe2+ 10-3 M. ( E°(Fe3+/Fe2+) = 0,77 V ; R= 8,31 J K-1 mol-1) réponse : Fe3+ + e- = Fe2+. E = E°(Fe3+/Fe2+) + 0,06 log ([Fe3+] / [Fe2+]) E= 0,77 + 0,06 log(0,025/10-3) = 0,85 V. On dose 20 mL d'une solution aqueuse de lactate de sodium (pKa ( CH3-CHOH-COOH / CH3-CHOH-COO-) = 3,9 ) par une solution HCl 1 M. Ecrire la réaction de titrage ? CH3-CHOH-COO- + H3O+ --> CH3-CHOH-COOH + H2O. Expression et la valeur du pH à la demi-équivalence, à l'équivalence :
0 l'équivalence on a une solution d'acide lactique, acide peu ionisé : pH= ½(pKa - log c) pH= 0,5(3,9 - log 0,72) = 2,0. - Concentration c de la solution de lactate de sodium si le volume équivalent vaut 14,3 mL ? A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques : Vlactate c = Véqui Cacide ; c = Véqui Cacide/ Vlactate = 1*14,3/20 = 0,72 mol/L.
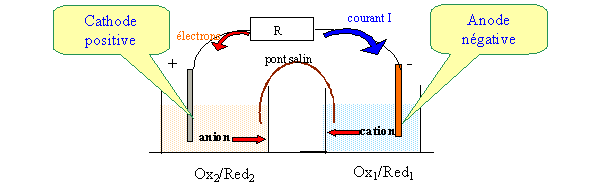
Indiquer les réactions aux électrodes, la réaction globale, le parcours des électrons et le sens de circulation du courant : Oxydation à l'anode : couple oxydant /réducteur : Ox1/red1 : red1 = Ox1 + n1 e-. Des électrons sont libérés, l'anode constitue le pôle négatif de la pile. Réduction à la cathode : couple oxydant /réducteur : Ox2/red2 : Ox2 + n2 e- = Red2. Bilan : n2 fois { red1 = Ox1 + n1 e-} n1 fois { Ox2 + n2 e- = Red2} n2 red1 + n1 Ox2 = n2 Ox1 + n1 Red2. Quel est le rôle de l'électrolyte : L'électrolyte assure la conduction électrique en solution : double migration des ions ( les ions positifs se déplacent dans le sens du courant ; les ions négatifs se déplacent en sens contraire ).
Li ion ; Pb/PbO2 ; Ni/MH ; Ni/Cd. Pb/PbO2 ( 30 Wh kg-1) ; Ni/Cd ( 50 Wh kg-1) ; Ni/MH ( 65 Wh kg-1) ; L ion ( 140 Wh kg-1)
Possède une haute densité d'énergie pour un poids très faible. Faible auto-décharge ( moins de 10 % par mois) ; pas d'entretien. ; pas d'effet mémoire. Ecrire la réaction d'insertion et de désinsertion de l'électrode positive des batterie Li-ion : À l'anode négative , le lithium (Li) s'oxyde en ions lithium (Li+) : Li = Li+ + e- ; l'ion Li+ d'insére dans la structure cristalline de la cathode LiCoO2. À la cathode positive, le matériau actif H se réduit : H + e- = H-. Donner un ou des électrolytes liquides utilisés dans les piles et/ou batteries au lithium et au Li-ion : chlorure de thionyle
SOCl2.
Donner la quantité d'électricité correspondant à cette réaction quantitative : Q= I t avec I en ampère et t en seconde Q = 1,5 10-3*4200 = 6,3 C. Nombre de moles de MnO2 réduit : MnO2 +H+ + e- = MnOOH La charge d'une mole d'électrons est, en valeur absolue, égale à 96500 C, d'où la quantité de matière d'électrons : n(e- )= 6,3 / 96500 = 6,53 10-5 mol. D'après les nombres stoechiométriques de l'équation ci-dessus : n(e- )= n(MnO2) =6,53 10-5 mol. Masse initiale de MnO2 ( 87 g/mol) : masse (g) = quantité de matière (mol) * masse molaire (g/mol) m= 6,53 10-5 *87 =5,68 103 g. |
|||||||
|
|
|||||||
|
|