|
concours assistant ingénieur chimiste, sciences des matériaux 2006 |
|||||||
|
|||||||
|
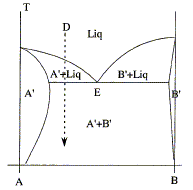
On considère le diagramme d'équilibre suivant entre deux métaux A et B en fonction de la température.
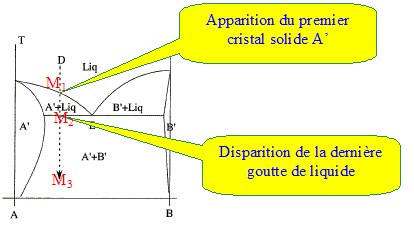
Quel genre de morphologie typique observe t-on pour un alliage riche en A refroidi lentement depuis l'état liquide selon la verticale D ? réponse : solution solide de substitution A' et B' : les deux solides cristallisent dans le même type de réseau cristallin avec des paramètres de mailles voisins; l'un des solides peut prendre la place de l'autre dans le réseau. Le premier cristal de A' apparaît ( point M1). La composition du liquide suit la courbe M1E ; la phase liquide s'appauvrit en A. En E apparaissent les premiers cristaux de B. Au point M2 il y a disparition de la dernière goutte de liquide. La température diminue encore et on arrive à M3.
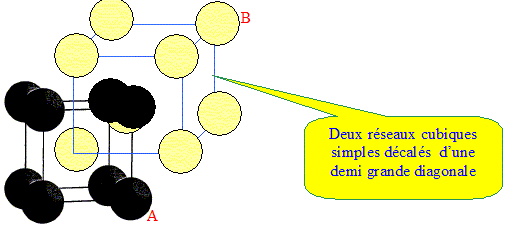
Même question pour un alliage ayant la composition du point E ? eutectique : mélange de deux corps purs qui fond et se solidifie à température constante. Du point de vue de la fusion, l'eutectique se comporte comme un corps pur. Un alliage (A, B) présente une structure cristallographique cubique dont la maille est représentée ci-dessous avec les atomes A en noir et les atome B en blanc. - Cet alliage est-il cubique simple, cubique centré ou cubique à faces centrées ? - Quelle est sa composition chimique AnBm ? réponse :
Chaque maille compte un atome de A et un atome B d'où la composition chimique AB.
L'air se comporte comme un gaz parfait R= 8,31 J K-1 mol-1 ; Mair = 29 g/mol. Calculer la masse de lest total ( incluant la nacelle et l'enveloppe) nécessaire pour maintenir la mongolfière en équilibre : La mongolfière est en équilibre sous l'action de son poids ( P= mg ) et de la poussée d'Archimède due à l'air P= rair V g. loi des gaz parfaits : PV= nRT avec n= masse (g) / masse molaire (g/mol) = m/M d'où rair = m/V = PM/(RT). rair = 105*29 10-3 / (8,31*(273+90)) = 0,961 kgm-3. mg = rair V g donne m = rair V= 0,961*1500 =1442 kg. Calculer le plafond théorique : La masse de l'aérostier et de son équipement est de 100 kg. La température est supposée constante ( 25°C) ainsi que le volume de l'enveloppe. L'évolution de la pression avec l'altitude est donnée par P= P0 exp (-H/7,5) avec H en km. m = rair V=PVM/(RT) = P0 exp (-H/7,5) VM/(RT) exp (-H/7,5) = mRT/(P0M V) = 100 *8,31*(273+25) / ( 105*0,029*1500) = 0,0569 -H/7,5 = ln 0,0569 = -2,866 soit H= 2,866*7,5 = 21,5 km.
Ordre de grandeurs des valeurs physiques suivantes : Température de l'azote liquide : -196 °C ou 77 K. Les températures de fusion du cuivre ( 1083 °C ), du fer ( 1535 °C ) , du tungstène (3410 °C). La température de ramollissement du verre : 610 °C La vitesse du son dans l'air
:
330 m/s.
26 protons et 56-26 = 30 neutrons. Donner la valeur de Z pour l'ion Fe2+. Z=26, élément fer. Donner la configuration électronique du fluor : F ( Z= 9). 1s2 2s2
2p5.
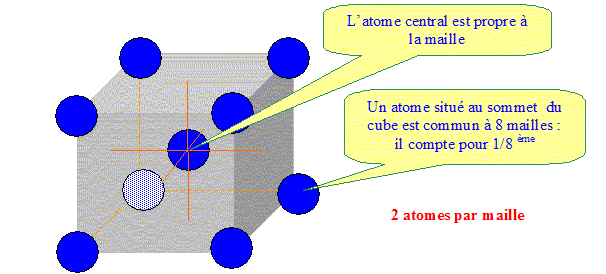
Représenter une maille, donner le nombre d'atomes par maille :
Calculer la masse volumique et en déduire la densité du chrome : masse de deux atomes de chrome : 2*MCr/NA = 2*0,052/ 6,023 1023 = 1,726 10-26 kg. volume de la maille : a3 = (2,8879 10-10)3= 2,41 10-30 m3. masse volumique : m/V = 1,726 10-26 / 2,41 10-30 = 7,17 103 kg m-3. densité :
d=
7,17.
Quelle est la concentration massique en H2SO4 ? masse d'acide pur dans 1 L : 1,78*0,86 = 1,53 kg /L = 1531 g/L. Quelle est la concentration molaire en H2SO4 ? masse molaire H2SO4 : M= 98 g/mol 1531 / 98 = 15,6 mol/L. Quel volume faut-il prélever pour préparer 1 L de solution 6 M ? Facteur de dilution : F= 15,6 / 6 = 2,6 volume à prélever : 1/2,6 =0,385 L = 385 mL. |
|||||||
|
|
|||||||
|
|